Поскольку при изобарическом процессе P постоянно, то после сокращения на P формула принимает вид
V1/T1=V2/T2,
или
V1/V2=T1/T2.
Формула является математическим выражением закона Гей-Люссака: при постоянной массе газа и неизменном давлении объём газа прямо пропорционален его абсолютной температуре.
Изотермический процесс
Процесс в газе, происходящий при постоянной температуре, называется изотермическим. Изотермический процесс в газе был изучен английским ученым Р.Бойлем и французским ученым Э. Мариотом. Установленная ими опытным путем связь получается непосредственно из формулы путем сокращения на T:
p1V1=p2V2,
или
p1/p2=V1/V2.
Формула является математическим выражением закона Бойля - Мариота: при постоянной массе газа и неизменной температуре давление газа обратно пропорционально его объему. Иначе говоря, в этих условиях произведение объёма газа на соответствующее давление есть величина постоянная:
PV=const
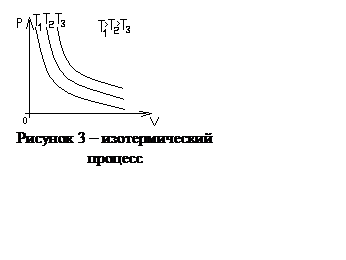 График
зависимости p от V при изотермическом процессе в газе представляет собой
гиперболу и называется изотермой. На рисунке 3 изображены изотермы для одной и
той же массы газа, но при разных температурах Т. При изотермическом процессе
плотность газа изменяется прямо пропорционально давлению:
График
зависимости p от V при изотермическом процессе в газе представляет собой
гиперболу и называется изотермой. На рисунке 3 изображены изотермы для одной и
той же массы газа, но при разных температурах Т. При изотермическом процессе
плотность газа изменяется прямо пропорционально давлению:
ρ1/ρ2=p1/p2
Зависимость давления газа от температуры при постоянном объеме
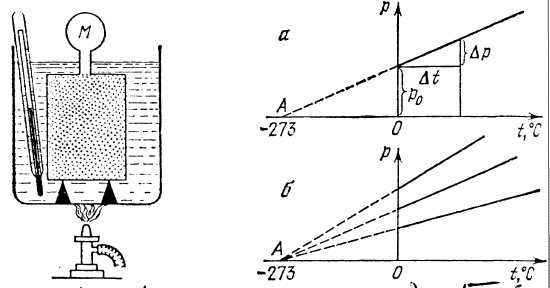
Рассмотрим, как зависит давление газа от температуры, когда его масса и объем остаются постоянными. Возьмем закрытый сосуд с газом и, будем нагревать его (рисунок 4). Температуру газа t будем определять с помощью термометра, а давление манометром М.
Сначала поместим сосуд в тающий снег и давление газа при 00С обозначим р0 , а затем будем постепенно нагревать наружный сосуд и записывать значения р и t для газа.
Оказывается, что график зависимости р и t, построенный на основании такого опыта, имеет вид прямой линии (рисунок 5).
Если продолжить этот график влево, то он пересечется с осью абсцисс в точке А, соответствующей нулевому давлению газа. Из подобия треугольников на рисунке 5, а можно записать:
P0/OA=Δp/Δt,
Или
l/OA=Δp/(p0Δt).
Если обозначить постоянною l/ОА через α, то получим
α = Δp//(p0Δt),
Δp= α p0Δt.
По смыслу коэффициент пропорциональности α в описанных опытах должен выражать зависимость изменения давления газа от его рода.
Величина γ, характеризующая зависимость изменения давления газа от его рода в процессе изменения температуры при постоянном объёме и неизменной массе газа, называется температурным коэффициентом давления. Температурный коэффициент давления показывает, на какую часть давления газа, взятого при 00С, изменяется при нагревании на 10С. Выведем единицу температурного коэффициента α в СИ:
α =l ΠA/(l ΠA*l0C)=l0C-1
При этом длина отрезка ОА получается равной 2730С. Таким образом, для всех случаев температура, при которой давление газа должно обращаться в нуль, одинакова и равна – 2730С, а температурный коэффициент давления α =1/ОА=(1/273)0С-1.
 |
 |

При решении задач обычно пользуются приближенным значением α равным α =1/ОА=(1/273)0С-1. Из опытов значение α впервые было определено французским физиком Ж. Шарлем, который в 1787г. установил следующий закон: температурный коэффициент давления не зависит от рода газа и равен (1/273,15)0С-1. Заметим, что это верно только для газов, имеющих небольшую плотность, и при небольших изменениях температуры; при больших давлениях или низких температурах α зависит от рода газа. Точно подчиняется закону Шарля лишь идеальный газ. Выясним, как можно определить давление любого газа р, при произвольной температуре t.
Δp=p1-p0,
Δt=t-0=t.
Подставив эти значения Δр и Δt в формулу, получим
p1-p0=αp0t,
или
p1=p0(1+αt).
Поскольку α~2730С, при решении задач формулу можно использовать в следующем виде:
p1=p0[1+(2730С)t]
К любому изопроцессу применим объединенный газовый закон с учетом того, что один из параметров остается постоянным. При изохорическом процессе постоянным остается объём V, формула после сокращения на V принимает вид
p1/T1=p2/T2,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.