Запыленный воздух из холодильника (12) очищается в циклонах (20) и с концентрацией пыли не более 60мг/м3 подается вентилятором (21) на абсорбционную очистку.Топочные газы и газы, выделяющиеся в трубчатом реакторе (4), в СБ объединяются с подсасываемым воздухом, в результате образуется газовоздушная смесь в объеме 150 000÷200 000м3/ч. Концентрация пыли ДАФ в такой смеси составляет ~3000мг/м3, а аммиака – 4000мг/м3. Поэтому вначале поток проходит циклоны (18), а затем вентилятором (19) нагнетается в пенный абсорбер (24) (высота – 17м, диаметр – 5м) – основной аппарат системы “большой” абсорбции. Абсорбер работает под избыточным давлением и орошается частично нейтрализованной фосфорной кислотой с температурой ~70°С, подаваемой в количестве до 500м3/ч из сборника абсорбционных растворов (22) (состав кислоты приведен выше). Сборник (22) подпитывается концентрированной фосфорной кислотой.Очищенный газ из абсорбера (24) проходит брызгоуловитель (25) и с концентрацией аммиака не более 80мг/м3 выбрасывается в атмосферу. Влага из брызгоуловителя (25) выпускается в сборник очищенных стоков (26).Парогазовая смесь из трубчатых реакторов (3) (Н2О + NH3 + HF + SiF4) вместе с пульпой поступает в АГ, где отделяется от жидкой фазы благодаря резкому увеличению объема. Эта смесь в АГ объединяется с подсасываемым воздухом, в результате образуется газовоздушная смесь в объеме ~50000м3/ч. Такой поток направляется в пенный абсорбер (29) (высота – 12м, диаметр – 2,4м) – основной аппарат системы “малой” абсорбции. Абсорбер работает под разряжением и орошается частично нейтрализованной фосфорной кислотой с температурой ~70°С, подаваемой из сборника абсорбционных растворов (27) (состав кислоты приведен выше). Сборник (27) подпитывается концентрированной фосфорной кислотой и соединен по периливу со сборником (22).Очищенный от аммиака газ из абсорбера (29) направляется в брызгоуловитель (30), в котором подвергается окончательной очистке от фосфосоединений. Брызгоуловитель орошается очищенными ливневыми стоками (~10м3/ч), состав которых близок к составу речной воды.Очищенный газ после брызгоуловителя (30) с концентрацией аммиака не более 80мг/м3 и фторсоединений – не более 10мг/м3 выбрасывается вентилятором (33) в атмосферу через выхлопную трубу высотой 200м.
58.Физико-химические особенности производства аммофоса и фосфатов аммония. Расчёт величин ∆ Н и ∆ G для реакций получения моно- и диаммонийфосфата. Дать полную характеристику струйному реактору и БГС, как основным аппаратам в производстве аммофоса.
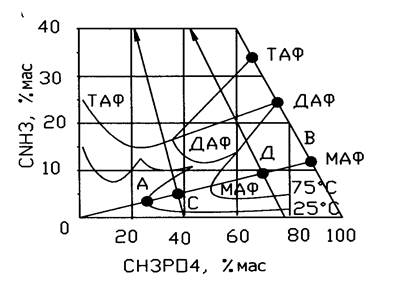
На рисунке показаны изотермы растворимости в системе аммиак – фосфорная кислота – вода при 25 и 75 ºС.
Взаимодействие ЭФК с NH3 происходит по реак-ям (1)-(3).
При этом концентрация фосфорной кислоты должна быть выше, чтобы в твердую фазу выделилось больше соли. Из рис. следует, что наибольшее выделение МАФ в твердую фазу достигается при осуществлении процессса по лучу АВ. При нейтрализаци фосфорной кислоты ( 40 % Н3РО4) выход кристаллов даже при 25 ºС невелик, система в т.С. При нейтрализации концентрированной ФК (75% Н3РО4) состав системы соответствует т.Д и количество, образовавшейся твердой фазы велико даже при температуре массы выше 75 ºС. Этому способствует и испарение части воды за счет теплоты экзотермической реакции. В производстве аммофоса применяют ЭФК, загрязненную примесями, поэтому в ходе нейтрализации кислоты аммиаком при рН >= 3 выделяются средние фосфаты железа и алюминия, дикальцийфосфат, магнийалюминийфосфат, гипс, фторидные и фторселикатные соли. При аммонизации ФК образуются кислые суспензии, содержащие кристаллы фосфатов аммония и соосаждающиеся примеси, а т/ж свободную ФК и воду. Количество и состав компонентов суспензии непрерывно меняется по мере поглощения аммиака и повышения температуры, меняются и свойства суспензии – рН, вязкость, текучесть, растворимость твердой фазы и др. Равновесное давление аммиака над насыщенным водным раствором зависит от молярного отношения NH3: Н3РО4. От этого отношения зависит и рН, по которому ведут регулирование процесса.
Тепловой эффект химической
реакции находится как разность м/д стандартными энтальпиями продуктов реакции и
исходных веществ с учетом их стехиометрических коэффициентов: 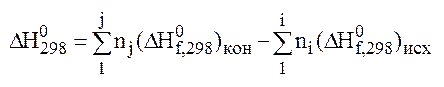 где
где ![]() -
тепловой эффект реакции при стандартных условиях (Т = 298,16 К; р
= 101325 Па), кДж;
-
тепловой эффект реакции при стандартных условиях (Т = 298,16 К; р
= 101325 Па), кДж; 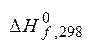 - стандартная мольная
энтальпия образования вещества, кДж/моль, табличные значения; ni и nj
- стехиометрические коэффициенты в уравнении реакции при исходных и конечных
веществах. Энтальпия простых веществ равна нулю.
- стандартная мольная
энтальпия образования вещества, кДж/моль, табличные значения; ni и nj
- стехиометрические коэффициенты в уравнении реакции при исходных и конечных
веществах. Энтальпия простых веществ равна нулю.
Энтропия химической реакции находится как разность м/д стандартными энтропиями продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов:
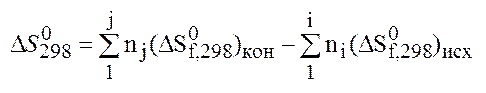 энтропия
простых веществ не равна нулю.
энтропия
простых веществ не равна нулю.
Свободная энергия Гиббса – часть полного запаса энергии системы кот. м. извлечь из нее при Р,V=const и превратить в полную работу. В нашем случае чтобы пошла прямая реакция (1). При DG<0 – процесс идет в прям направлении, DG>0 – процесс идет в обратном направлении, при DG=0 – устанавливается равновесие.
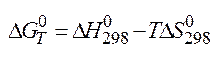
Струйный реактор:
1) по фазовому состоянию: гетеро. 2) по тепловому эффекту - экзо. 3) по температуре низкотемпературный.(50-70 ºС) 4) по давлению - 0,3 МПа . 5) по степени перемешивания – РИВ РИС? 6) по темперному режиму:– политерм 7) по времени – непрерыв.
БГС:
1) по фазовому состоянию: гетеро. 2) по тепловому эффекту эндо?. 3) по температуре низкотемпературный (160 ºС) 4) по давлению - 10-15 Па (разряжение). 5) по степени перемешивания – РИС .6) по температурному режиму:– адиаб? 7) по времени – непрерыв.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.