![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Гири нужны для уравновеши
Гири нужны для уравновеши![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() d l вания
давления ( Р )
d l вания
давления ( Р )
W = F d l
Газ F - сила, действующая на поршень
d l - изменение положения поршня
![]() F = P S ; S - площадь поршня
F = P S ; S - площадь поршня
d W = P S d l = Р d ( S l ) = Р d V
![]()
![]() a)
P б)
P
a)
P б)
P
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() P1
I P1
I
P1
I P1
I
![]()
![]()
![]()
![]()
![]()
![]() W W
W W
![]()
![]()
![]()
![]() P2
II P2 II
P2
II P2 II
V1 V2 V V1 V2 V
I и II - начальные и конечные состояния идеального газа. В случае а) с поршня снимают по одной гири, а в случае б) - по две, из-за этого и ход кривой, отражающий изменения объема и давления, разный. Площади, заключенные под кривыми - это и есть работа, совершаемая системой. Из графиков видно, что работа, совершаемая газом при расширении разная. Значит, работа зависит от пути протекания процесса, поэтому и не является функцией состояния.
Теперь докажем, что теплота не является функцией состояния. Теплота, сообщаемая системе, расходуется на изменение внутренней энергии (U) и совершение работы (W).
dQ = d U + dW ( 1 )
Так как работа не является функцией состояния, значит и теплота не является функцией состояния.
Уравнение (1) отражает первый закон термодинамики - закон сохранения энергии.
Выводы из первого закона термодинамики:
1. В изолированной системе, сумма всех видов энергии постоянна, не зависимо протекают в ней процессы или нет.
2. Не возможно построить вечную машину, такую, с помощью которой можно совершать работу не подводя энергию.
3. Все виды энергии переходят друг в друга в эквивалентных количествах.
4. Внутренняя энергия является однозначной функцией состояния системы.
5. Бесконечно малое изменение внутренней энергии - есть полный дифференциал (dU). Полный дифференциал - есть функция состояния системы.
Максимальная работа расширения идеального газа.
Под работой в общем виде понимают все виды работ:
W = Wмехан. + Wнемехан.
Единственной формой работы идеального газа есть механическая работа.
dW = Р d V ( 2 )
1. Максимальная работа расширения идеального газа в изотермическом процессе
(Т = const). Воспользуемся уравнением Менделеева
-Клапейрона, из которого вырази значение давления ![]()
Подставим значение давления в уравнение (2)
![]()
Проинтегрируем полученное уравнение:
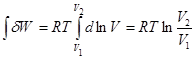
Получаем значение работы в изотермическом процессе:
![]()
2. Максимальная работа расширения идеального газа в изобарном процессе (Р = const). Воспользуемся уравнением механической работы:
dW = Р d V = d ( PV )
Проинтегрируем полученное уравнение:
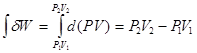
Получаем значение работы в изобарном процессе:
WP=const = P2V2 - P1V1
3. Максимальная работа расширения идеального газа в изохорном процессе (V= const).
dW = Р d V = 0
Так как в изохорном процессе объем постоянен, и изменения объема не происходит, поэтому работа не совершается.
4. Максимальная работа расширения идеального газа в изобарно-изотермическом процессе. Это характерно для газовой системы, в которой происходит химический процесс (P = const, T = const)
3H2 + N2 = 2NH3
W = P2V2 - P1V1 = P DV = P(2VNH3 - 3VH2 - 1VN2) = DnPV = DnRT
W = DnPV = DnRT
4. Максимальная работа расширения идеального газа в адиабатическом процессе (dQ = 0)
dQ = d U + dW
dW = - d U = -CV d T ( 3 )
CV - изохорная теплоемкость , это количество теплоты необходимое для нагрева системы на 10
Проинтегрируем полученное уравнение (3):
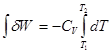
WQ=0 = CV (T2 -T1)
Частные случаи применения первого закона термодинамики.
Для идеального газа единственным видом работы является механическая.
dQ = d U + Р d V
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.