9.Катализаторы процесса синтеза аммиака. Кинетика и механизм каталитической реакции. Колонна синтеза аммиака: устройство, потоки газа и температурный режим. Уравнение для расчета молярной теплоты реакции синтеза.
9.1. Синтез аммиака протекает с заметной скоростью только в присутствии катализатора. Скорость синтеза аммиака на железном катализаторе, активированном Al2O3 и K2O определяется ур-ем Темкина – Пыжова:
υ=k1*PN2(PH23/ PNH32)α - k2* (PNH32/ PH23)1-α ;
υ- скорость реакции,
k1- константа скорости образования аммиака прямой р-ции;
k2- константа скорости разложения аммиака обратной р-ции.
Заметим, что k1/k2 = K.(К-константа равновесия)
Pi- парциальные давления участников р-ции,
α – постоянная удовлетворяющая неравенству 0<α<1, α - характеризует степень покрытия поверхности катализатора азотом.
|
t, 0С |
425 |
475 |
525 |
|
k1 |
3200 |
22700 |
118000 |
Для промышленных катализаторов α=0,5 при 400-5000С. Значение энергии активации для промышленных кат-ров 167,5 кДж/моль. На поверхности катализатора протекают следующие промежуточные стадии:
1. N2(газ) → 2N(адсорбируются на атомы); Лимитирующей - наиболее медленной являетсяся стадия 1
2. H2(газ)→2H(адсорбируется на атомы); активированная адсорбция газообразного N2 катализатором.
3. N(адс) + H(адс)→NH(адс); Медленно протекает и стадия 3-
4. NH(адс)+ H(адс)→ NH2(адс); присоединение 1-го атома Н2 к сорбированному N.
5. NH2(адс)+ H(адс) → NH3(адс).
Катализаторы: В промышленности распространен железный катализатор (магнетит Fe3O4 сплавляют с промоторами). Катализаторы активируют восстановлением водорода. Широко используетсяся СТК марка СА-1(Fe 32-38% и Al2O3, K2O, CaO). Его выпускают в дробленом и гранулированном виде. Он предназначен для работы в колоннах синтеза при 400-5000С до 60 МПа и содержании в АВС кислородных соединений до 40см3/м3. При этих условиях катализатор обеспечивает стабильную работу 3-5лет. Если нет яда до 8 лет. Есть СА-2 для работы при 475-600С.
9.3.КОЛОННА (см. рис.):
мощность агрегата 1360т/сут, Р = до 32Мпа. Вертикальный аппарат, состоит из
нижнего и верхнего корпусов высокого давления и насадки. 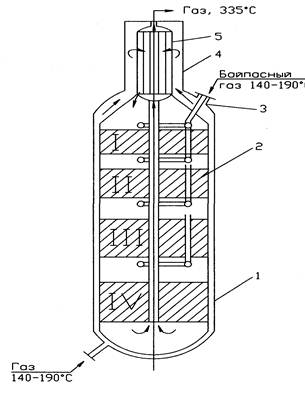
1 – нижний корпус; 2 – насадка; 3 – штуцер байпасного газа; 4 – верхний корпус; 5 – трубчатый теплообменник. I-IV-полки кат-ра
Нижний корпус: внутренний диаметр = 2,4 м; толщина стенки 25см, Н = 22м.
Верх корпус: внутренний диаметр = 1м, стенка 11см, Н=6,5м.
Насадка 2 состоит из катализаторной коробки и теплообменника 5 (1920труб Ø-ром 12мм). Катализатор размещен на 4 полках, объем и масса увеличиваются по ходу движения газов.
1 полка объем катализатора 7,1м3; 2 -8,4 м3; 3 –12.8 м3; 4 –14.7 м3.
Движение газовых потоков: Перед колонной синтеза газовая смесь (3,3% об NH3) делится на 5 потоков. Основной идет вниз колонны, поднимается по кольцевому зазору (между корпусом и катализаторной коробки) и идет в межтрубное пространство теплообменника. В нем газ нагревается до 400-4400С за счет выходящего горячего из катализаторной коробки газа и идет в катализаторную зону на 1 полку. На полке образуетсяся NH3 из АВС. 4 другие линии служат для ввода байпасного газа перед каждой полкой, чтобы регулировать температуру р-ции синтеза. Пройдя 4 слоя катализатора газовая смесь (14-16% об. NH3), температура 480-5300С поток поворачивает в центральную трубу, идет вверх в трубное пр-во теплообменника, где охлаждаетсяся до 3350С и выходит из колонны.
Температурный
режим колонны: 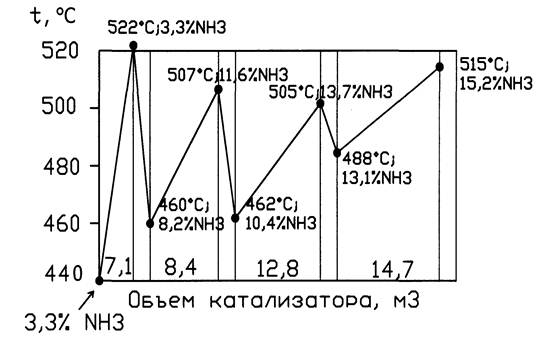 распределение катализатора по полкам нужно для поддержания оптимального
уровня температуры колонны и исключения перегрева катализатора. Для отвода
тепла между слоями катализатора подают байпас.
распределение катализатора по полкам нужно для поддержания оптимального
уровня температуры колонны и исключения перегрева катализатора. Для отвода
тепла между слоями катализатора подают байпас.
Тепловой эффект реакции синтеза NH3 зависит от температуры и давления и м.б. рассчитан по ур-ю:
q = f(T,Р),
где q – тепловой эффект р-ции, кДж/кмоль NH3;
Т – средняя температура в зоне катализа, К;
Р – давление в зоне катализа, МПа.
Это ур-е используется для точных расчетов, упрощенно – через энтальпии участников реакции.
38.Мультиплетная теория катализа академика А. Баландина, её основные положения применительно к реакции синтеза аммимака.
Каталитической активностью обладают участки поверхности катализатора. Теория предполагает, что в образовании поверхностного соединения участвуют группы активных атомов поверхности (мультиплеты), они обладают определенными геометрическими и энергетическими свойствами. Теория рассматривает принципы геометрического и энергетического соответствия.
Геометрическое соответствие: твердое тело м.б. гетерогенным катализатором р-ции, если расположение активных мест на его поверхности находится в геометрическом соответствии с расположением атомов в молекулах реагировавших веществ, т е расстояния между атомами на поверхности катализатора и в молекуле д.б. одинаковы.
Энергетическое соответствие: величины энергетической связи между атомами в мультиплете д.б. равны энергетической связи между атомами в реагировавших молекулах, чтобы катализатор был достаточно активен. энергетический уровень мультиплетного комплекса д. располагаться по середине между энергетическим уровнем исходных веществ и продуктов, а энергия его образования и распада д.б. минимальна.
С2Н4+Н2=С2Н6, никелевый катализатор. связь С-С =0,154 нм; Ni-Ni = 0,264. Это мультиплет комплекс, примерно то же самое с аммиаком.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.