Задача к билету №
Равновесие реакции конверсии метана:
lgK
= 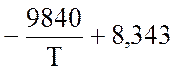 lgT – 2,059 ·10-3 · Т +
0,178 · 10-6 · Т2 – 11,96
lgT – 2,059 ·10-3 · Т +
0,178 · 10-6 · Т2 – 11,96
Напишите эту реакцию. Рассчитайте К при 9000С.
Рассчитайте величины ΔH и ΔG для реакции паровой конверсии метана (ΔG – при t= 900 оС).
Рассчитайте величины ΔH и ΔG для реакции паровой конверсии монооксида углерода (ΔG – при t= 300 оС).
В 1950-е годы производительность типового азотнокислотного агрегата равнялась 50000 т/год, в 1970-е – 120000 т/год, а в 1980-е – 360000 т/год. Рассчитайте относительные экономические показатели, соответствующие возрастанию единичной мощности агрегата.
Равновесие реакции конверсии СО:
lgK
= 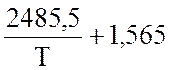 lgT – 0,066 ·10-3 · Т +
lgT – 0,066 ·10-3 · Т + 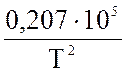 – 6,946
– 6,946
Напишите эту реакцию. Рассчитайте К при 400 оС.
Приготовте раствор КАС состава А (Δ диаграмма), если сырьем является 75 %-ный карбамид, 55%-ный нитрат аммония и твердый нитрат аммония. Масса исходного 75%-ного карбамида составляет 50 кг. Нанесите на диаграмму изолинии температур кристаллизации и изолинии содержания общего азота в растворах. Установите следующее:
1) состав системы СО(NH2)2-NH4NO3-Н2О в т. А (в % масс.);
2) рассчитайте массу остального сырья и массу продукта;
3) какую температуру кристаллизации имеет раствор КАС состава А?
4) Каково содержание общего азота в удобрении состава А?
Расчет количества реакционного тепла, выделяющегося при нейтрализации азотной кислоты аммиаком.
Протекает реакция:
NH3(г) + HNO3(ж) = NH4NO3(т), ΔH = -146,49 кДж
Рассчитайте количество тепла, выделившегося при образовании 2 т нитрата аммония.
Расчет годовой потребности в магнезитовом порошке для агрегата АС-72М
Производительность агрегата АС-72М составляет 450000 т/год аммиачной селитры. Массовая доля нитрата магния в аммиачной селитре равна 1,3 %.
Сырьем при получении нитрата магния из оксида магния служит ПМК-83 («порошок магнезитовый каустический»), массовая доля MgО в котором составляет 83 %. Рассчитайте годовую потребность агрегата В ПМК-83.
1) состав системы HNO3 – Н2О - Н2SO4 в т. А (в % масс.);
2) азотная кислота какой концентрации необходима для приготовления смеси кислот состава А?
3) какова масса смеси кислот?
4) какую температуру кипения имеет смесь состава А?
5) какой состав паровой фазы при кипении данной смеси?
Расчет количества реакционного числа, выделяющегося при каталитической очистке хвостовых газов.
Хвостовой газ на выходе из абсорбционной колонны содержит 3,3 % об. О2 и 0,20 % об. NO. Расход хвостового газа составляет 30000 нм3/ч. Газ подается на каталитическую очистку. Рассчитайте количество реакционного тепла и расход восстановителей для следующих вариантов:
1. Неселективная очистка по реакциям:
2О2 + СН4 = СО2 + 2Н2О, ΔH = - 803 кДж. (1)
при этом остаточное содержание О2 в газе составляет 0,3 % об.;
4NO + CH4 = 2N2 + CO2 + 2H2O, ΔH = -1165 кДж. (2)
при этом NO расходуется полностью.
2. Селективная очистка по реакции:
при этом NO расходуется полностью.
Над раствором азотной кислоты (45 % масс. HNO3) находятся в равновесии при t = 60 оС газообразные NO, NO2 и N2O4. При этом равновесное давление NO2 (х) рассчитывается из уравнения:
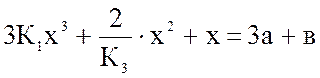 , (1)
, (1)
где К1 - …………..; К3 - …………; а - ………….; в - ……………
При этом lgK1 = 1,68; а = 0,080 ат; в = 0,2000 ат;
LgK3 вычисляется из уравнения
lgK = -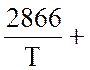 lgT +
6,251, (2)
lgT +
6,251, (2)
Рассчитайте равновесное давление оксидов азота по компонентам и общее равновесное давление NOх.
Задача к билету №
Расчет степени окисления NO в NO2.
Объемный расход нитрозного газа через полый аппарат-окислитель (V=30м3) составляет 55000 нм3/ч. Объемная доля NO в газе на входе в аппарат равна 2,6 %, а кислорода – 4,0 %. Абсолютное давление составляет 7 ат., а температура – 80 оС. Рассчитайте степень окисления NO в результате прохождения нитрозного газа через окислитель и объем образовавшегося NO2.
Задача к билету №
1. Время окисления аммиака на платиноидном катализаторе при 900оС составило 8,34·10-5с. Время окисления τ и степень конверсии аммиака до NO α связаны следующим уравнением:
lgτ = -0,107α + 7,02·10-6α3.
Рассчитайте величину α.
3. В контактном аппарате протекает реакция:
2NH3 + 2,5O2 = 2NO + 3H2O, ΔH = -453,5 кДж
при этом прореагировало 40 кг аммиака.
Какой объем воздуха поступил при этом в контактный аппарат, если его избыток составил 30%? Сколько тепла выделилось?
Задача к билету №
Рассчитайте по уравнению Михельса
lgС NH3
= 2,3592 +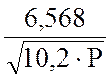 -
- 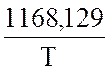 .
.
величину С NH3 после I и II ступени конденсации.
Укажите смысл параметра «СNH3». Конденсация происходит при следующих условиях:
I ступень: Р = 23 МПа, t = 30 оС;
II ступень: Р = 25 МПа, t =-10 оС.
Вычислите степень извлечения аммиака из газа на I ступени и общую, если объемная доля NH3 в газе на входе в I ступень равна 15 %.
Величину теплового эффекта реакции синтеза аммиака рассчитывается по следующему уравнению:
q = 38276,7
+ (23,00 +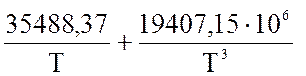 ) Р + 22,35 ·Т + 10,55·10-4·
·Т2 – 7,08 ·10-6 · Т3
) Р + 22,35 ·Т + 10,55·10-4·
·Т2 – 7,08 ·10-6 · Т3
Напишите уравнение реакции. Рассчитайте величину q для следующих условий:
Р = 26 МПа, t = 460 оС.
Задача к билету №
Для реакции синтеза аммиака
N2 + 3H2 ↔ 2 NH3 , ΔH = -92 кДж
Константу равновесия обратной реакции 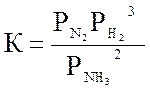
где (Рi – в ат.) рассчитывают по уравнению Ларсона и Доджа:
lg![]() =
= 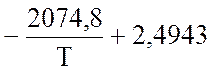 lgТ
+
lgТ
+ ![]() + I,
+ I,
где β и I – функции давления.
Рассчитайте ![]() и К для следующих
вариантов:
и К для следующих
вариантов:
1) t = 460 оС, Р = 26 МПа; 2) ) t = 530 оС, Р = 40 Мпа
Установите, какой из факторов – температура или давление – оказывают более сильное влияние на равновесие.
Задача к билету №
Горячий конвертированный газ, выходящий из шахтной печи, последовательно охлаждается в двух котлах-утилизаторах - I и II. Рассчитайте количество утилизируемого тепла к котле I, если состав влажного газа после шахтной печи следующий (% об.):
H2 – 37, N2 – 14, CO – 8, CO2 – 5, CH4 – 0,3, H2O – остальное.
Температура газа на входе в котел I составляет 1027 оС, а на выходе из котла 627 оС. Расчет выполните на 10 м3 влажного газа.
Задача к билету №
Кислород в смесителе шахтного реактора взаимодействует с восстановителями при 1200 оС по следующим экзотермическим реакциям:
Н2 + 0,5О2 = Н2О (1)
СО + 0,5 О2 = СО2 (2)
Всего расходуется 10 м3 кислорода, при этом 95 % О2 – в реакции (1), 5 % - в реакции (2). Рассчитайте общее количество выделившегося тепла.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.