Правила названий веществ рекомендуется изучить, используя алгоритм названий веществ.
IВыбираютв формуле наиболее длинную углеводородную цепь и нумеруют атомы углерода в ней, начиная с того конца цепи, к которому ближе разветвление.
IIНазывают радикалы при помощи цифр указывают их место у нумерованных атомов углерода.
Например:
![]() СН3
СН3
![]() СН3 – СН2 – С – СН3
СН3 – СН2 – С – СН3
![]()
СН3
2,2 диметилбутан
Изучить тему «Алканы» рекомендуется проводить по следующей схеме (алгоритму).

Химические свойства: реакций горения, замещения, разложения, и т .д. Запишите в виде уравнения.
Уравнение реакций.
1.
2.
3.
4.
5.
6.
При изучении вопроса : строение алканов запишите:
1. Вид гибридизации.
2. Длина связи (расстояние между атома углерода)
3. Валентный угол.
Для закрепления материала заполните таблицу: Химические свойства алканов на примере пентана.
|
Химические свойства |
Уравнение реакций |
|
1. Реакция горения |
С5Н12 +О2--- |
|
2. Галогенирование |
|
|
3. Термическое разложение |
|
|
4. Дегидрирование |
|
|
5. Изомеризация |
Вопросы для самоконтроля.
1. Приведите названия предельных углеводородов, которые имеют формулы:
СН3-СН2-СН2-СН3
СН3 – СН 2– СН 2– СН2 – СН3
СН3 С2Н5
![]() СН3 – СН – СН2 – СН3
СН3 – СН – СН2 – СН3
![]()
С3Н7
2. Изобразите структурную формулу 2,2,4 тирметилпентана.
3. Изобразите электронные формулы метана и этана. Поясните, как образуется химические связи в молекулах этих веществ при перекрывании соответствующих электронных облаков.
4. Запишите уравнение реакций, при помощи которых можно получить пропан.
5. Какой объем воздуха потребуется, чтобы сжечь 50л газа пропана.
Литература: Л-2 стр.12-21
Л-3 стр.302-309
Л-5 стр.67-80
Тема 2.3. Непредельные углеводороды
Студент должен:
Знать: общую формулу алкенов, алкинов, диеновых углеводородов, гомологический ряд и виды изомерии; их химические свойства и практическое применение.
Уметь: составлять структурную формулы алкенов, алкинов, диеновых углеводородов; называть их по систематической номенклатуре: составлять уравнение реакций, характеризующих химические свойства непредельных углеводородов; определять по характерным реакциям непредельные углеводороды; соблюдать правила безопасности при работе с органическими веществами.
Алкены. Общая формула алкенов. Этилен. Его структурная формула. Электронное строение. Виды связи SP2 – гибридизация атомов углерода. Гомологический ряд этиленовых. Систематическая номенклатура. Получение алкенов. Химические свойства алкенов: реакция ионного присоединения (взаимодействие с галогенами, галогеноводородами, водородом, водой). Объяснения правила Марковникова с позиций электронного строения реагирующих веществ (на примере пропена). Окисление алкенов перманганатом калия. Горение. Полимеризация Понятие: мономер, полимер, степень полимеризации, свойства полиэтилена. Применение этиленовых углеводородов.
Диеновые углеводороды. Понятие о диеновых углеводородах, их общая формула, систематическая номенклатура: виды изомерии. Сопряженные системы с открытой цепью (например бутадиен 1,3). Особенности электронного строения углеводородов c сопряженными двойными связями. Химические свойства диеновых в сравнении с алкенами. Склонность диеновых к реакциям присоединения по месту 1,4 двойных связей. Окисление перманганатом калия. Полимеризация бутадиена 1,3 и изопрена. Природный и синтетические каучуки, их применение.
Алкины. Ацетилен. Его структурная и электронная формулы: SР- гибридизация углеродного атома. Гомологический ряд ацетилена. Общая формула алкинов. Виды структурной изомерии. Систематическая и рациональная номенклатура алкинов. Химические свойства. Реакции ионного присоединения. Реакции замещения водорода при углероде с тройной связью на металл ( образование ацетиленидов). Реакции полимеризации. Окисление перманганатом калия. Реакция М.Г Кучерова. Получение и приминение ацетилена.
Методические указания
При изучении данной темы студент должен уяснить:
Непредельные углеводороды – соединения в молекула которых, между атомами углерода имеются кратные связи (двойные или тройные).
Алкены – углеводороды с двойной связью (СН2=СН-СН3) пропен.
Диеновые – углеводороды с двумя двойными связями. Например:СН2=СН-СН=СН2- бутадиен 1,3.
Алкины- углеводороды в молекулах которых, между атомами углерода имеется тройная связь. Например: СН=С-СН2-СН3 – бутин 1.
Реакции полимеризации – процесс соединения многих одинаковых молекул в более крупные.
п СН2=СН2 (-СН2-СН2-)n
Полиэтилен
Мономер – вещество вступающее в реакции полимеризации (этен).
Полимер – вещество полученное в результате реакции полимеризации (полиэтилен).
Степень полимеризации – количество молекул, вступивших в реакции полимеризации.
Изучение вопроса строение непредельных рекомендуется описать в виде таблицы.
Таблица 3.
|
Непредельные углеводороды |
Общая формула |
5 гомологов |
Вид гибридиза ции |
Валентный угол |
Длина связиС1-С2 |
|
Диеновые |
|||||
|
Алкены |
|||||
|
Алкины |
Химические свойства, получение применение непредельных углеводородов, предлагаем изучить по следующей схеме
Схема 2
![]()
![]()
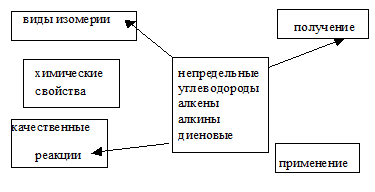
Вопросы для самоконтроля
Почему число углеродов у алкенов больше, чем у предельных
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.