Тогда весь объем водорода вытесненный цинком, будет составлять (0,345*х)л
4. Найдем какой объем водорода вытесняет из кислоты 1г железа:
56г железа вытесняет 22,4 л Н2 (по закону Авогадро)
1г железа вытесняет у1, л Н2
![]()
Тогда объем всего Н2, вытесняемого железом, будет: (18,6-х)*0,4л
5. Составим уравнение с одним неизвестным и решим его:
0.345х+0,4(18,6-х)=6,72
0,055х=0,72
х=13,1г (масса Zn в смеси)
6. Находим массовую долю цинка в смеси
![]()
![]()
6. Находим массовую долю железа в смеси
100%-70,43%=29,57%
Ответ:70,43% Zn и 29,57% Fe
Задача 2
При действии концентрированной азотной кислоты на 10г смеси алюминия с медью выделилось 2.24л газа, измеренного при н.у. Определить массовую долю меди и алюминия в смеси.
Решение
Алюминий с концентрированной азотной кислотой не взаимодействует, а медь реагирует с выделением оксида азота(IV):
![]()
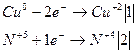
1. Находим количество вещества NO2 и Сu:
![]()
![]()
По уравнению реакции n(Cu):n(NO2)=1:2, поэтому: n(Cu)=0,1:2=0,05 моль
2. Находим массу прореагировавшей меди:
![]()
m(Cu)=0?05моль*64г/моль=3,2г
3. Находим массовую долю меди в смеси:
![]()
![]()
![]()
4. Находим массовую долю алюминия в смеси:
W(AI)=100%-32%=68%
Ответ: 32% Сu и 68%AI
Задачи для самостоятельного решения
1. На 10,4 г смеси цинка с оксидом цинка подействовали раствором гидроксида натрия. Выделившийся газ после сжигания образовал 0,72 г воды. Определить массовую долю цинка в смеси.
Ответ: 25%
2. При взаимодействии 5г образца карбоната натрия с раствором соляной кислоты выделилось 0,896л оксида углерода (IV), измеренного при н.у. Определить массовую долю Na2CO3 в исследуемом образце.
Ответ: 84,8%
3. К раствору, содержащему избыток хлорида железа (III), прилили раствор, содержащий 240г гидроксида натрия. Определить массу и количество образовавшегося гидроксида железа (III).
Ответ: 214г; 2моля
4. Задачи на вычисление массы продукта реакции, если известна массовая доля выхода продукта реакции по сравнению с теоретически возможным выходом.
Задача 1
Сколько тонн ортофосфорной кислоты можно получить из 31т ортофосфата кальция, если выход кислоты составляет 0,8 массовых долей или 80% по сравнению с теоретическим?
Решение
1. Записываем уравнение реакции
![]()
![]()
2. Находим количество вещества ортофосфата кальция:
![]()
![]()
3. Находим количество молей ортофосфорной кислоты.
По уравнению реакции из 1 моль ортофосфата кальция образуется 2 моль фосфорной кислоты значит из 1*1050 моль Са3(РО4)2 образуется 2*105моль Н3РО4 (при теоретическом 100% выходе).
![]()
![]()
4. Определяем массу выхода теоретически возможного Н3РО4
![]()
![]()
5. Определяем массу практически полученной Н3РО4
![]() отсюда
отсюда
![]()
![]()
Ответ: 15,68т
Задача 2
При восстановлении 250г нитробензола реакцией Зинина получили 150г анилина. Вычислите, сколько это составляет процентов по сравнению с теоретическим выходом.
Решение
1. Записываем уравнение реакции
![]()
2. Находим молярные массы
![]()
![]()
3. Находим количество молей нитробензола
![]()
4. Находим количество молей анилина.
По уравнению реакции из 1 моль нитробензола получаем 1 моль анилина
![]()
![]()
5. Находим массу теоретически полученного аналина
![]()
6. Находим массовую долю выхода аналина по сравнению с теоретическим.
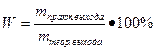
![]()
Ответ: 82%
Задачи для самостоятельного решения
1.Сколько граммов нитробензола можно получить из 312г бензола, если массовая доля выхода нитробензола составляет 75%, по сравнению с теоретическим.
Ответ: 369г
2. Из 140т жженой извести получили 183т гашеной извести. Сколько процентов, или массовых долей, это составляет от теоретически возможного выхода%
Ответ: 93,38%
4. На гашенную известь взятую в необходимом количестве, подействовали 3,15кг чистой азотной кислоты. Какую массу нитрата кальция Са(NO3)2 получили, если практически выход в массовых долях составляет 0,98 (или98%) по сравнению с теоретическим?
Ответ: 4,02кг.
Перечень литературы
1. Гурецкая В.Л. Органическая химия М.: Высшая школа,1983
2. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии. М.: Высшая школа, 1988
3. Потапов В.М., Хомченко Г.П. Химия. М.: Высшая школа, 1985
4. Фельдман Ф.Г., Рудзитис Г.Е. Химия. М.: Просвещение, 1992
5. Габрилян О.С. Лысова Г.Г. Химия. М.: Дрофа, 2001
6. Шамова М.О. Учимся решать расчетные задачи по химии. М.: Школа-Пресс, 2001
7. Берман. Решение типовых задач. М.: Филологическое общество «Слово», 1997
8. Хомченко И.Г. Решение задач по химии. М.: Новая Волна, 2001
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.