3. Зная, что 1 моль вещества содержит 6,02*1023 структурных единиц, находим число молекул в 6г воды
![]() где
N-число молекул, NA-число Авогадро
где
N-число молекул, NA-число Авогадро
N=0,33 моль*6,02
4. Определяем массу одной молекулы
![]()
Ответ: 3*1023 г
Определите массу 5,6л кислорода при н.у.
![]() Решение
Решение
Согласно следствия из закона Авогадро моль любого газа при н.у. занимает объем 22,4л. Этот объем называется молярным объемом (Vm). Молярный объем газа это отношение объема газа к количеству этого газа.
![]()
1. Находим количество кислорода, содержащегося в 5,6 л
![]() моль
моль
2. Находим массу 0,25 моль кислорода
m= M(O2)*n=32г/моль*0,25моль=8г
Ответ: 8г
Определите массовые доли элементов в оксиде литие Li2O.
1. Находим молярную массу указанного вещества.
![]()
2. Находим массовую долю лития в оксиде лития по формуле
W-массовая доля элемента
n-количество атомов химического элемента
М- молярная масса вещества
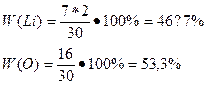
Сколько железа можно получить из 1т руды, состоящей из 60% FeO и 40% Fe2O3?
1. Находим молярные массы FeO и Fe2O3
М(FeO)=56+16=72г/моль
М(Fe2O3)=56*2+16*3=160г/моль
2.
По формуле ![]() находим
массу FeO в руде:
находим
массу FeO в руде:
![]()
3. Находим массу железа в 600кг FeO
n(Fe) в FeO=1
![]()
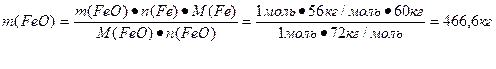
4. Находим массу Fe2O3 в 1000 кг (1т) руды
1000кг-600кг=400кг
5 Находим массу железа в 400кг Fe2O3
![]()
n(Fe) в Fe2O3 = 2
![]()
5. Находим общую массу железа в руде.
466,6+280=746,6 кг
Ответ: 746,6 кг
Какая масса оксида кальция может быть получена из 500т известняка, содержащего 20% примесей.
Решение
1. Находим массу чистого известняка.
100%-20%=80%
![]()
2. Составляем уравнение реакции
![]()
3. Находим молярные массы веществ СаСО3 и СаО
М(СаСО3)=40+12+3*16=100г/моль
М(СаО)=40+16=56г/моль
4.
Находим количество моль СаСО3 по формуле
ν=![]()
![]()
По уравнению реакции ν СаСО3= νСаО=40*105моль
5. Находим массу СаО во формуле
![]()
m(CаО)=40*105 моль*56 г/моль= 224*106г=224т
Ответ: 224т
Задачи для самостоятельного решения.
Самостоятельно решите следующие задачи.
1. Какое количество вещества содержится в а) 112г КОН; б)320г О2
Ответ: а) 2; б)10
2. Сколько молекул содержится в а) 4,9г Н2SO4; б)20г Н2?
Чему равна масса одной молекулы перечисленных веществ?
Ответ: а)3*1022; 1,63*10-22
б) 6,02*10124; 3,37*10-24г
3. Определите массовую долю в % каждого элемента, входящего в состав следующих веществ: а) СаSO4; б)NaNO3; в) ZnCI2
Ответ: а) 29,4%, 23,53%, 47, 0о%;
б)27,06%, 16,5%, 56,47%
в) 47,8%, 52,2%
4. Руда содержит 70% ZnS и 30% ZnO. Сколько цинка можно получить из 10кг такой руды?
Ответ: 7,09кг
5. Сколько алюминия можно получить из 500кг руды, содержащей 90% АI2O3?
Ответ 238,2 кг
2.Задачи на определение формул химических веществ.
Формулы химических веществ показывают их качественный и количественный состав. Задача по установлению формулы химического вещества сводится к определению числа молей составляющих его атомов элементов и вычислению их соотношения. При этом расчет можно производить для любой массы или количества анализируемого вещества, так как соотношение будет оставаться постоянным.
Задача 1
Анализ показал, что соединение состоит из 30,43% азота и 69, % кислорода. Плотность этого вещества по водороду равна 46. Определите формулу вещества.
Решение
1. Обозначим формулу вещества NxOy.
2. Определим число моль Nи О, входящих в состав анализируемого вещества. Расчет в данном случае целесообразно проводить для массы анализируемого вещества равной 100г, тогда масса входящих в него атомов составляет 30,43г, а кислорода 69,57г
М(N)=14г/моль
М(О)=16г/моль
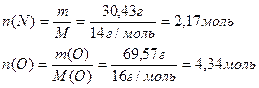
3. Определяем соотношение числа моль атомов N и О и приводим его к целым числам.
![]()
![]()
Простейшая формула NO2
4. Определяем молярную массу анализируемого вещества
![]() М(NxOy)=
М(NxOy)=![]() *46г= 92г/моль
*46г= 92г/моль
5. Находим отношение молярной массы исследуемого вещества к молярной массе простейшей:
![]()
6. Простейшую формулу умножаем на 2 (NO2)*2
Следовательно, истинная формула вещества – N2O4
Ответ: N2O4
Задача 2
При сгорании 4,8г органического вещества образовалось 6,6г оксида углерода (IV) и 5,4г воды. Плотность этого вещества по водороду равна 16. Определите молярную формулу вещества.
Решение
1. Обозначим формулу вещества СxHy или CxHyOz, так как без предварительных расчетов невозможно установить наличие в нем атомов О.
2. Определяем число моль атомов С и их массу, содержащихся в 6,6г СО2:
М(С)=12г/моль
М(СО2)=12+2*32=44г/моль
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.