![]()
1 мольСО2 содержит 1 моль атомов С
0,15мольСО2 содержит Х моль атомов С
Х=0,15
n(C)=0,15моль
![]()
По условию эта масса и количество вещества содержится а анализируемом веществе.
3. Определяем массу и число моль атомов Н, содержащихся в 5,4г воды.
M(H)=1г/моль
М(Н2О)=18г/моль
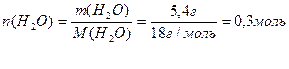
1 моль молекул воды содержит 2 моль атомов Н
0,3 моль молекул воды содержит Х моль атомов Н
Х=0,6 моль
![]()
4. Определяем входит ли в состав анализируемого вещества кислород. Суммарная масса атомов элементов С и Н, входящих в состав вещества
mв-ва=1,8+0,6=2,4г
По условию масса сгоревшего вещества равна 4,8г следовательно, в его состав входит и О с массой : 4,8-2,4=2,4г
5. Определяем число моль и массу атомов кислорода:
m(O)=2,4 формула СxHyOz
M(O)=16г/моль
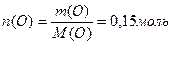
6. Определяем соотношение числа моль атомов С, Н, О и приведем соотношение к целым числам:
![]()
Простейшая формула СН4О или СН3ОН
7. Определяем молярную массу анализируемого вещества:
![]()
![]()
М(СН3ОН)=32г/моль
Истинная формула СН3ОН – метанол.
Ответ: СН3ОН
Задачи для самостоятельного решения
1. В состав спирта входит углерод с массовой долей 52,17%, кислород с массовой долей 34,78% и водород, с массовой долей 13,05%. Плотность паров этого спирта по водороду 23. Определите формулу данного спирта и дать название веществу по международной номенклатуре.
Ответ: С2Н5ОН
2. При сгорании 0,9г вещества образовалось 1,32г оксида углерода (IV) и 0,54г воды. Известно, что плотность этого вещества по водороду равна 90. Найдите молекулярную формулу вещества.
3. Задачи на вычисления, связанные с использованием массовых долей растворимых веществ.
Содержание вещества в растворе выражается массовой долей. Массовая доля растворенного вещества – это отношение массы этого вещества к массе раствора:
![]() (1)
(1)
![]() (2)
(2)
Из формулы 2 можно получить расчетные формулы 3,4:
m(в-ва)=W*m(р-ра)
![]()
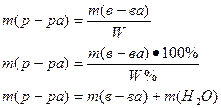
Молярность (или молярная концентрация) – величина равная отношению количества растворенного вещества к объему раствора и число моль в 1л раствора:
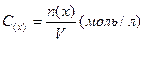
Задача 1
Найти массы воды и хлорида калия, необходимые для приготовления 250г раствора с массовой долей КСI 15%
Решение
1. Найдем массу КСI , необходимую для приготовления 15% раствора:
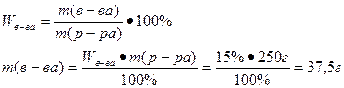
2. Найдем массу воды: 250-375=212,5г
Ответ: 37,5г КCI и 212,5г Н2О
Задача 2
Вычислите массовую долю (%) хлорида меди (II) в растворе, содержащем 30г СuCI2 и 170 г воды.
Решение
m(р-ра)=m(СuCI2)+m(H2O)= 30г +170г=200г
![]()
Ответ: 15%
Задача 3
Вычислите молярную концентрацию раствора,3л которого содержит 31,5г азотной кислоты.
Решение
1. Найдем количество молей азотной кислоты в растворе
![]() где
М(НNO3)= 1+14+3*16=63г/моль
где
М(НNO3)= 1+14+3*16=63г/моль
2. Находим молярную концентрацию раствора
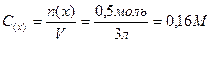
Ответ: 0,16М
Задачи для самостоятельного решения.
Задача 1
Смешали 200г воды и 40г глюкозы. Определить массовую долю глюкозы в полученном растворе.
Ответ: 12,5%
Задача 2
Какова должна быть концентрация (%) раствора сахара С12Н22О11, чтобы в нем на каждый моль сахара приходилось 20моль воды?
Ответ: 48,7%
Задача 3
Сколько граммов гидроксида натрия необходимо для приготовления 500мл 0,1М раствора? Как приготовить такой раствор?
Ответ: 2г КОН разбавить водой до 500мл
3. Расчеты по химическим уравнениям.
Задача 1
В промышленности карбид кальция получают по схеме:
![]() .Вычислить,
сколько потребуется оксида кальция для получения карбида кальция массой 3,2г.
Какой объем СО (у.н.) выделится?
.Вычислить,
сколько потребуется оксида кальция для получения карбида кальция массой 3,2г.
Какой объем СО (у.н.) выделится?
Решение
1. Записываем уравнение реакции и молярные массы веществ:
![]()
М(СаО)=40+16=56г/моль
М(СаС2)=40+2*12=64г/моль
2. Найдем количество моль карбида кальция (переведем тонны в граммы):
![]()
![]()
3. Найдем по уравнению реакции количество моль СаО:
n(CaO):n(СаС2)=1:1, следовательно, n(CaO)=5*104моль
4. Найдем массу оксида кальция:
![]()
5. Найдем объем выделившегося СО:
по уравнению n(CaO):n(CO)=1:1, следовательно n(CO)=5*104моль
![]()
![]()
Ответ: 2,8 т СаО и 1,12*106 л СО
Задача 2
При обработке 18,6г смеси цинка и железа раствором соляной кислоты выделилось 6,72л водорода, измеренного при н.у.. Определить массовые доли железа и цинка в смеси.
Решение
1. Записываем уравнение реакции:
а)![]()
б)![]()
M(Zn)=65г/моль
М(Fe)=56г/моль
Так как оба металла выделяют водород, то массу одного из них примем за х г
m(Zn)=x г, тогда m(Fe)=(18,6г-х)г
3. Найдем, какой объем водорода вытесняется из кислоты 1г цинка:
65г цинка вытесняет 22,4л Н2 (по закону Авогадро)
1х цинка вытесняет у л Н2
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.