Система послед.соед.РИП-выходы прод-тов приближ.к выходам прод-тов пр-са в 1-ом РИВ.
70. Кинетика реакций, проводимых в растворе.
При рассмотрении процессов в растворах необходимо учитывать структуру и природу растворителя и растворенного вещества, структуру, химический состав раствора и условия протекания реакции.
Растворители бывают полярные или неполярные Растворы: ионные и молекулярные, концентрированные и разбавленные, идеальные и неидеальные. Структура чистых жидкостей – пространственные группы молекул (тетраэдр, тригональная бипирамидальная, октаэдр и др). Из сочетания 2-х, 3-х и более полиэдров создается ансамбль полиэдров. Число молекул растворителя, окружают такую же молекулу или ион – координационное число. При растворении в растворителе жидкости, газа или тв. вещества происходит их диспергирование до молекул или ионного состояния. Молекулы или ионы растворенного вещества занимают пустоты в полиэдрах или разрушая их, создают новые.
Реагирующее вещество вступает не в форме индивидуальных молекул, а в форме сольватов. Молекула движется в «клетке» из молекул растворителя, движение колебательное и, следовательно, число столкновений больше, чем в газе, т. к. молекулы плотно упакованы в жидкости. W= kcini, k зависит от природы растворителя. Мономолекулярные реакции в жидкостях и в газовой фазе происходят с одинаковыми скоростями.
Пусть
в растворе протекает реакция: A+B![]() A..B
A..B ![]() C , раствор
неидеальный.
C , раствор
неидеальный.
По
ЗДМ 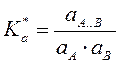 или
или 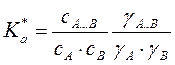 ,где
a и y – активности и коэффициенты активности
,где
a и y – активности и коэффициенты активности
Концентрация
переходного состояния: ![]() . По теории
переходного состояния
. По теории
переходного состояния ![]() , h-постоянная
Планка При
, h-постоянная
Планка При ![]() получим
получим ![]() Скорость
химической реакции зависит от природы растворителя. Так при y=10
скорость реакции в растворе в 10 раз выше чем в газовой фазе.При y=1
скорость реакции в растворе = скорости в газовой фазе.
Скорость
химической реакции зависит от природы растворителя. Так при y=10
скорость реакции в растворе в 10 раз выше чем в газовой фазе.При y=1
скорость реакции в растворе = скорости в газовой фазе.
Для
мономолек.р-ции A ó
A* -> продукты 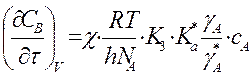 и
при
и
при ![]() получим:
получим:
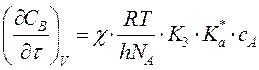 , т.е. скорость реакции не зависит от
природы растворителя.
, т.е. скорость реакции не зависит от
природы растворителя.
71.
Влияние ионной силы на скорость реакции, проводимой в растворе.
Во всех уравнениях химической кинетики фигурируют концентрации реагирующих веществ. В термодинамике же константа равновесия неидеальной системы выражается через активности. Это обстоятельство необходимо учитывать, если в кинетическое уравнение входит константа равновесия. Правда, при реакциях в газовой фазе и между нейтральными молекулами в растворе в этом нет практической необходимости, но при рассмотрении реакций между заряженными частицами подобное пренебрежение может явиться источником существенных ошибок.
Для константы скорости бимолекулярной реакции A+ В → AВ* → продукты протекающей в растворе, теория активного комплекса, ;дает
κ=χ![]()
Термодинамическая константа равновесия
между исхешшми веществами и активным комплексом κ*= ![]() =
=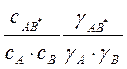
Комбинируя уравнения, получим уравнение
Бренстеда — Бьеррума: κ=χ![]() =К0
=К0 ![]() для константы скорости реакции, протекающей в
любой неидеальной среде. Величина К0 имеет смысл константы
скорости при бесконечном разведении, т. е. при γ= 1.
для константы скорости реакции, протекающей в
любой неидеальной среде. Величина К0 имеет смысл константы
скорости при бесконечном разведении, т. е. при γ= 1.
Если в качестве стандартного состояния
выбрать бесконечное разведение, теория электролитов дает следующее приближенное
соотношение для коэффициента активности: γ= ![]() ,где
А — постоянная≈ 0,51; z —заряд иона; I— ионная сила
раствора; β — некоторая постоянная, примерно обратно пропорциональная радиусу
иона.
,где
А — постоянная≈ 0,51; z —заряд иона; I— ионная сила
раствора; β — некоторая постоянная, примерно обратно пропорциональная радиусу
иона.
Если zA и zB —
соответствующие заряды реагирующих частиц, то реакция может быть записана в
виде AZa+Bzb→AB*(Za+Zb) → продукты а подстановка соответствующих значений
коэффициентов, активности в уравнение Бренстеда — Бьеррума дает ![]()
Рассмотрим два случая.
1. Взаимодействие между заряженными частицами.
Сумма ![]() мала,
и для случая взаимодействия между двумя ионами ими можно пренебречь, т. е.
мала,
и для случая взаимодействия между двумя ионами ими можно пренебречь, т. е. ![]()
Следовательно, логарифм константы скорости, согласно теории должен быть линейной функцией корня квадратного из ионной силы, а тангенс угла наклона прямой определяется соотношением зарядов реагирующих частиц.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.