Сред. ионный коэф. активности γ+/- явл. универсальной функцией ионной силы I р-ра, т.е. в р-ре с данной ионной силой все диссоциирующие в-ва им. коэф-ты активности, не зависящие от природы и концентрации данного в-ва, но зависящие от числа и валентности его ионов.
23. Факторы, влияющие на электропроводность растворов, скорости движения и подвижность ионов.
1. природа иона
2. напряженность поля E/l
3. концентрации. (уд. э\проводность на графике ae=f(с,моль\л)- радуга; экв.э\проводность λ=с,г*экв\л – горка вогнутая к 0, вниз.
4. температуры (с ней растут уд.э\проводность и предел подвижности, у металлов наоборот)
5. вязкости среды
24. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
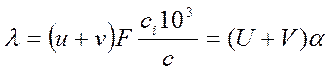
I. 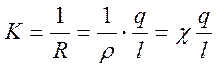 -
электропроводность, где
ρ – удельное электрическое сопротивление
-
электропроводность, где
ρ – удельное электрическое сопротивление
q – площадь электрода (далее поперечное сечение сосуда,[см2]
l – расстояние между электродами
χ – удельная электропроводность, [ом-1•см-1]
II. 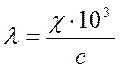 - эквивалентная
электропроводность, [см2/(г-экв•ом)]
- эквивалентная
электропроводность, [см2/(г-экв•ом)]
где с – эквивалентная концентрация, [г-экв/л]
III. I = I++I- - количество электричества, перенесенное ионами через раствор в 1 сек
![]() - количество катионов, прошедшее через поперечное
сечение за 1 сек
- количество катионов, прошедшее через поперечное
сечение за 1 сек
![]() - сила тока, т.к. каждый г-экв ионов несет согласно
закону Фарадея
- сила тока, т.к. каждый г-экв ионов несет согласно
закону Фарадея
F=96486 K эл-ва.
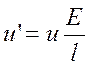 - скорость катионов, где
u – абсолютная подвижность катионов, [см2/сек*в]
- скорость катионов, где
u – абсолютная подвижность катионов, [см2/сек*в]
Аналогичные формулы для анионов (v, v’, c-, n-, I-)
Получаем:
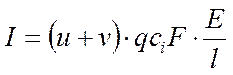
IV. 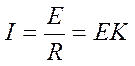 - закон Ома
- закон Ома
Подставим в это выр-е значение К из (I) и (II), и приравняв правые части уравнений (III) и (IV), получим
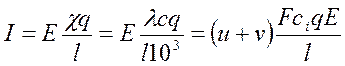
Решив уравнение относительно λ, получим
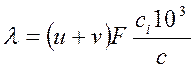
¨ для сильных электролитов, диссоциация которых считается полной, отношение 103сi/с=1
¨ для слабых - 103сi/с=α
V. Учитывая подвижности катионов и анионов,
V=v*F и U=u*F
получаем заданное выражение для разной степени диссоциации электролитов.
25. Основные положения теории сильных электролитов
Дебая-Хюккеля.
Эти представления сформулированы в виде идеи о наличии вогруг каждого иона ионной атмосферы из противоположно заряженных ионов. Ее плотность макс. у центра, с удалением от него ↓. На некотором расстоянии, которое можно считать границей ионной атм., кол-во ионов каждого знака одинаково. Термодинамические св-ва р-ров электролитов теория связывает с параметрами ионной атм. – ее размером и плотностью.
1. Электролит в растворе диссоциирован полностью, и кон-ция ионов рассчитывается по аналитической кон-ции электролита.
2. Распределение ионов в ионной атмосфере подчиняется классич. статике, а сама ионная атмосфера рассматривается как непрерывная среда.
3. Из всех видов взаимодействия учитывая только электростатическое взаимодействие ионов. Растворителюлю отводится роль среды с некоторой диэлектрической проницаемостью.
4. Диэлектрическая проницаемость р-ра принимается равной диэлектрической проницаемости чистого растворителя.
5. Из всех свойств ионов учитывается только заряд.
26. Что такое ионная атмосфера, релаксационное и электрофоретическое торможение?
Ионная атмосфера
Если мысленно выделить в разбавленномрастворе сильного электролита один центральный ион, то ионы противоположного знака будут чаще наблюдаться около него, чем ионы с одноименным зарядом. Такое статистическое распределение ионов устанавливается под влиянием 2-х факторов:1) электростатических сил притяжения и отталкивания; 2) теплового движения ионов. В результате вокруг центрального иона устанавливается некоторое промежуточное статистическое распределение ионов – ионная атмосфера.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.