![]()
![]() О
О
![]()
![]()
![]() Н С + 2 [Ag(NH3)2]NO3 + H2O 2 Ag + HCOONH4 +
Н С + 2 [Ag(NH3)2]NO3 + H2O 2 Ag + HCOONH4 +
![]() Н
Н
+ NH3 + 2 NH4NO3
б) с реактивом Несслера (K2HgI4 + KOH)
![]()
![]()
![]() O
O
![]()
![]()
![]() R C + K2HgI4
+ 3 KOH Hg + RCOOK + 4 KI + 2 H2O
R C + K2HgI4
+ 3 KOH Hg + RCOOK + 4 KI + 2 H2O
H
Реакция используется для определения примеси альдегидов в эфире для наркоза.
в) с реактивом Фелинга (сегнетова соль с CuSO4) – щелочной раствор тартратного комплекса меди (II)
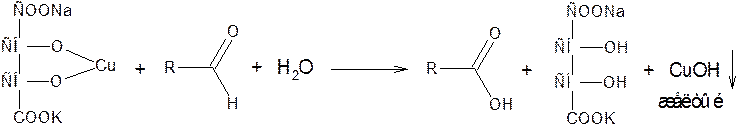
![]() toC
toC
![]() 2 CuOH Cu2O
+ H2O
2 CuOH Cu2O
+ H2O
красный г) с раствором йода в щелочной среде. Используется в основном для количественного определения, например, формальдегида
![]()
![]() О
О
![]()
![]()
![]() Н
С + I2 + Н2О
HCOOН + 2 НI
Н
С + I2 + Н2О
HCOOН + 2 НI
Н
![]() I2 + 2 NaOH NaI + NaOI + H2O
I2 + 2 NaOH NaI + NaOI + H2O
![]() NaOI + NaI + H2SO4
I2 + Na2SO4 + H2O
NaOI + NaI + H2SO4
I2 + Na2SO4 + H2O
![]() I2 (изб.)
+ 2 Na2S2O3
2 NaI + Na2S4O6
I2 (изб.)
+ 2 Na2S2O3
2 NaI + Na2S4O6
Кето-группа менее реакционноспособна, чем альдегидная, поэтому реакции окисления альдегидной группы для кето-группы не характерны. Общими для них являются реакции замещения.
2. Реакции нуклеофильного присоединения а) с гидроксиламином солянокислым (NH2OH * HCl)
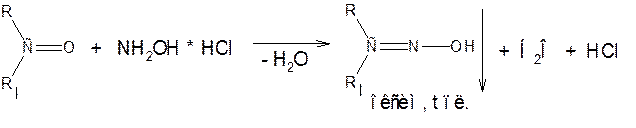
б) с производными гидразина NH2 – NH – R
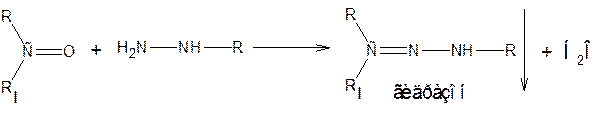
Простая эфирная и алкоксигруппа
а) расщепление под действием конц. H2SO4 и HI
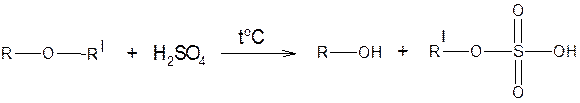
б) расщепление под действием сильных оснований
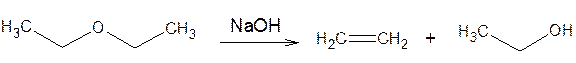
в) получение оксониевых солей при действии конц. H2SO4 (в случае димедрола – ярко-желтое окрашивание, переходящее в кирпично-красное) и разрушение соли при добавлении нескольких капель воды (исчезновение окраски).
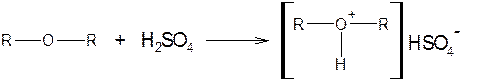
Простые эфиры подвержены окислению, они реагируют с кислородом (даже с кислородом воздуха, особенно на свету) с образованием перекисей и гидроперекисей.
В фармацевтическом анализе широко применяют реакции образования оксониевых солей и расщепление конц. серной кислотой, а также реакции окисления простых эфиров.
Карбоксильная группа
1. Образование комплексных соединений с солями тяжелых металлов
![]()
![]() R – COOH
+ MeX RCOOMe + HX
R – COOH
+ MeX RCOOMe + HX
Образуются окрашенные осадки или растворы комплексных соединений.
2. Образование сложных эфиров при взаимодействии со спиртами.
В фармацевтическом анализе используются реакции солеобразования с гидроксидами щелочных металлов (количественный анализ), солями тяжелых металлов (анализ подлинности), а также реакции этерификации.
Сложно-эфирная группа
1. Гидролиз (кислотный и щелочной)
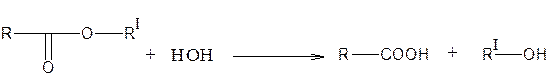
Способность сложноэфирной группы подвергаться гидролизу широко используется как при анализе подлинности, так и в количественном анализе.
Широкое применение находит и реакция образования гидроксамовой кислоты (при взаимодействии с гидроксиламином) и ее хелатного комплекса с ионами Fe3+.
2. Реакция образования гидроксамовых кислот с последующим получением гидроксаматов металлов (чаще Fe или Cu).
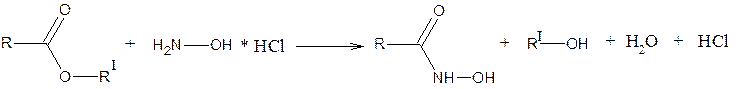
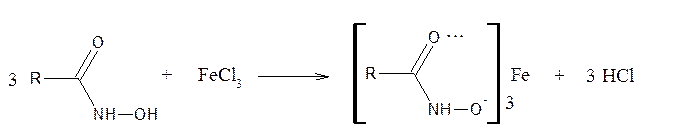
Лактонная группа
В фарманализе лактонов используются реакции гидролиза и образования гидроксаматов железа.
1. Гидролиз
![]()
![]()
![]()
![]()
![]()
![]() С О COOH
С О COOH
![]() +
HOH
+
HOH
![]() О ОН
О ОН
2. Образование гидроксаматов.

Первичная ароматическая аминогруппа
1. Образование соли диазония
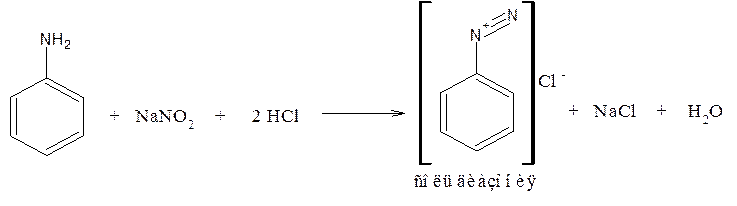
Реакция используется для количественного определения методом нитртометрии. Избыточная капля NaNO2 вызывает изменение окраски индикатора (внутренний – тропеолин 00; метиловый красный + метиленовый синий)
![]() Или изменение окраски йодкрахмальной бумажки (внешний
индикатор).
Или изменение окраски йодкрахмальной бумажки (внешний
индикатор).
![]()
![]() 2 KI + 2 NaNO2 + 4 HCl I2 + 2 KCl
+ 2 NaCl + 2 NO + 2 H2O
2 KI + 2 NaNO2 + 4 HCl I2 + 2 KCl
+ 2 NaCl + 2 NO + 2 H2O
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.