ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
Национальный исследовательский университет ресурсоэффективных технологий «ТПУ» (НИУ РЭТ ТПУ).
Химико-технологический факультет.
Кафедра ТООС и ВМС
Направление-24000 «Химия и биотехнология».
Лекционный курс-«Химия и технология органических веществ»
Задание для практических занятий
1. Рассчитать и построить зависимость теплоемкости веществ от температуры, в указанных интервалах (по 10-ти точкам).
2. Рассчитать и построить зависимость теплоемкости веществ от давления, в указанных интервалах и температуре (по 7-ми точкам).
Варианты:
|
№ варианта |
Вещество |
Интервал t 0С для графика теплоемкости от температур |
Параметры для графика теплоемкости от давления |
|
|
t 0С |
Интервал Р, атм |
|||
|
1 |
Хлорбензол |
100…900 |
300 |
1…5 |
|
2 |
Этанол |
40…600 |
200 |
60…200 |
|
3 |
н-бутан |
30….800 |
130 |
20…100 |
|
4 |
Этилен |
40…900 |
25 |
10…250 |
|
5 |
Пропилен |
25…800 |
90 |
2…400 |
|
6 |
Ацетон |
50…900 |
230 |
2…400 |
|
7 |
С3Н8 |
40…900 |
150 |
3…200 |
|
8 |
Аммиак |
30…700 |
140 |
40…300 |
|
9 |
Метан |
30…800 |
30 |
5…400 |
|
10 |
СО2 |
25…1000 |
20 |
4…300 |
|
11 |
Азот |
25…500 |
25 |
10…400 |
|
12 |
Водород |
25…900 |
0 |
5…100 |
|
13 |
Этан |
30…800 |
25 |
3…200 |
|
14 |
Метан |
40…900 |
90 |
40…300 |
|
15 |
Пропан |
40…600 |
230 |
5…400 |
Практическая реализация расчета зависимости теплоемкости от давления исходит из уравнения, которое для 1 моля реального газа можно записать в форме
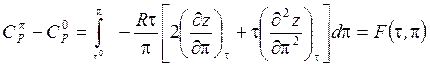 (6.40)
(6.40)
На рис. 6.5 дана зависимость Срp-Ср° для реальных газов, построенная путем графического интегрирования. Пользуясь, этим рисунком, легко вычислить теплоемкость реального газа при повышенных давлениях.
Таблица 6.3.
Критические константы веществ
|
Вещество |
Tc, K |
Pc, атм |
Zc |
Вещество |
Tc, K |
Pc, атм |
Zc |
|
Водород |
33,3 |
12,8 |
0,292 |
бензол |
562,7 |
48,6 |
0,274 |
|
Кислород |
154,8 |
50,1 |
0,292 |
толуол |
592 |
41,6 |
0,27 |
|
Азот |
126,1 |
33,5 |
0,291 |
Этилбензол |
619,6 |
37 |
0,272 |
|
Хлор |
417,2 |
76.1 |
0,276 |
о-ксилол |
632,2 |
36 |
0,254 |
|
СО |
132,9 |
34,5 |
0,294 |
Кумол |
635,9 |
32 |
0,263 |
|
СО2 |
304,2 |
73 |
0,274 |
Метилциклогексан |
572 |
34,3 |
0,25 |
|
НCl |
324,6 |
81,5 |
0,266 |
Н-нонан |
595,2 |
22,5 |
0,250 |
|
Аммиак |
405,6 |
111,5 |
0,242 |
Метанол |
513,2 |
78,5 |
0,222 |
|
Вода |
647,6 |
218,3 |
0,23 |
Ацетальдегид |
461,2 |
54,7 |
0,257 |
|
Метан |
191,1 |
45,8 |
0,29 |
Этанол |
516,2 |
63,0 |
0,248 |
|
Этан |
305,5 |
48,2 |
0,285 |
Ацетон |
508,7 |
46,6 |
0,237 |
|
Этилен |
282,1 |
50,5 |
0,270 |
Уксусная к-та |
594,8 |
57,1 |
0,260 |
|
Пропилен |
365 |
45,6 |
0,274 |
Нитрометан |
588,2 |
62,3 |
0,223 |
|
С3Н8 |
369,9 |
42,0 |
0,277 |
Анилин |
699,2 |
52,4 |
0,250 |
|
н-бутан |
425,2 |
37,5 |
0,274 |
Хлористый метил |
416,3 |
65,9 |
0,276 |
|
н-С5Н12 |
469,5 |
33,8 |
0,269 |
Хлороформ |
536,6 |
54 |
0,294 |
|
н-С6Н14 |
507,3 |
29,9 |
0,264 |
Хлорбензол |
632,4 |
44,6 |
0,265 |
|
н-С6Н26 |
659 |
17,9 |
0,238 |
Диметиламин |
456,2 |
55,5 |
0,280 |
Учитывается, что критические константы являются характеристическими свойствами газов, и поэтому их можно использовать для создания соответствующей относительной шкалы, введя безразмерные приведенные переменные: приведенное давление Рпр, приведенный объем Vпр и приведенную температуру Тпр:
Тпр=Т/Ткр; Рпр=Р/Ркр; Vпр=V/Vкр; rпр=r/rкр (6.22)
где T, P,V, - рабочие температура, давление и объем.
В ряде литературных источников принято обозначение приведенных параметров с индексом r- pr, Vr, Tr, также распространено обозначение Рпр-p, а Тпр как t и т. д.
Пример 6.2.1.2. Сравнить рассчитанную мольную теплоемкость метана при 100 атм и 300 К с экспериментальными данными, зная Ткр= 191,1, Ркр=45,8 (из табл. 6.3).
Из уравнения 6.7 и используя коэффициенты из таблицы А2 имеем
Ср = а + b10-3T + с 10-6T2+d10-9T3=
17,45+60,46 10-3 300+1,117 10-6 3002-7,20 10-93003= 35,49 дж/моль К.
ТС= Тпр=300/191,1=1,56; Рпр= РС= 100/45,8=2,18
Из рис. 6.5: DСР = 14,2; откуда Ср = 35,49+14,2=49,69 дж/моль К.
Далее рассчитанное значение теплоемкости, переводим в размерность дж/кгК через соответствующую пропорцию.
Молярная масса метана равна М=12+4=16
Таким образом 16 грамм имеют Ср - 49,5
а 1000 грамм (кг) имеет Ср – х
Откуда х=1000´49,5/16=3093 дж/кг К.
А из экспериментальных данных, представленных на рис. 6.4 при 100 атм и 300 К имеем значение теплоемкости -3050 дж/кгК.
Пример 6.2.1.3 [1].Определить изменение теплоемкости СО2, если при 100 0С давление увеличивается от 0,1 до 30 МПа. Для диоксида углерода из табл. 5.3 Тк=304 К, рк=7,3 МПа.
В таблице значение рк приведено в атмосферах, поэтому переводим его в Мпа.
Приведенная температура равна t=373/304=1,23, а приведенное давление (p) меняется от 0,014 (практически от нуля) до 4,11. Из рис. 6.5 находим, что при t=1,23 и p=4,11 величина Ср4,1-Ср° составляет приблизительно 50 Дж/(моль-К).
Теплоемкость газа при 100 0С равна
Cр =а + b10-3 Т + с'105/Т2 =
=44,14+9,04 10-3373- 8,53 105/3732=41,38 Дж/(моль-К).
Следовательно Ср4,1=41,38+50=91,38 Дж/(моль-К).
Интересно отметить, что, как правило, при p>4 разность Срp-Ср0 остается неизменной: Срp>4-Ср°»Ср4-Ср°. Кроме того, что важно для последующего рассмотрения, Срp-Ср° практически равна нулю при p£0,05 и t³1,5.
Пример 6.2.1.4. Вычислить теплоемкость смеси азота (1) и этилена (2) при 102,29 ати и 25 0С с мольными долями 0,25 и 0,75 соответственно. Известны из табл. 6.3: Ср1=29,09 и Ср2 = 43,63 дж/моль К; Ркр.1 = 33,5 иРкр. 2 = 50,5 атм; Ткр. 1 = 126,1 и Ткр. 2 = 283.
Решение. Вначале переводим значение давления из технических атмосфер в физические атмосферы, а затем переходим к абсолютному давлению.
Рфиз. атм= 102,29´0,96784=99 атм
Рабс=99+1=100 атм
Рпр 1 = 100/33,5 = 3; Рпр.2 = 100/50,5 = 1,98
Тпр.1 = 298/126,1 = 2,4; Тпр.2 = 298/283 = 1,05.
По рис. 6.5:
DСР. = СР1-С°Р1=3,76 и DСР. = СР1-С°Р1 = 91,96; Ср1 = 29,09 + 3,76= 32,85; Ср2 = 43,63 + 91,96= 135,59;
Тогда теплоемкость смеси при заданных условиях будет
С100р = S хiСрi = 0,25´32,85 + 0,75 ´135,59= 109,9 дж/моль К
Без учета давления теплоемкость смеси
Ср = S хiСрi = 0,25´29,09 + 0,75 ´43,63= 39,9 дж/моль К
Таким изменением теплоемкости (275 %) смесей в инженерных расчетах явно нельзя пренебрегать
|
Примечание.Номограмма специально взята из [2], т. к. на ней имеются опечатки-в верхней части номограммы значения Срp-Ср°, равные 15, 20, 30 к сожалению приведены в кал/моль К, а не в дж/моль К, как это сделано для остальных значений и заявлено автором. Таким образом, студентам, которые при расчетах попадают в данную область номограммы, необходим соответствующий перевод значений.
ТЕПЛОЕМКОСТЬ
Теплоемкость-это количество тепла, которое нужно затратить, чтобы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.