Dа = 3,08- (-33,90+ 3´27,28) =--44,86
Db 103 =565,8-(471,87+ 3´3,26 ) = 84,15
Dс 106 = -300,4- (-298,34 + 3´0) = -598,8
Dd109 =62,06-(70,84+3´0) =-8,78
D с! 10-5 = 0-(0+3´0,502)= -1,506
Тогда, согласно формулы 5.3 имеем
DH1000 = -250,12´1000+(- 44,86 (1000-298)) + 0,5´84,15´10-3 (10002-2982) +1/3´(-598,8) 10-6 (10003-2983)+.0,25 ´(-8,78) 10-9 (10004 -2984) - (-1,506 105 (1000-1-298-1) = -246470 дж/моль = - 246,47 кдж/моль=
Примечание. Множитель 1000 уDHТ1 появляется для перевода размерности кдж в дж, т. к. теплоемкости выражены в дж/моль К.
Пример 5.2. Вычислить теплоту реакции дегидрирования бутана до 1,3-бутадиена при 600оС
С4Н10 (Г) ¾® С4Н6(Г) + 2 Н2(Г)
Находим по таблице A1 и А2 стандартные теплоты образования и коэффициенты температурной зависимости теплоемкости веществ и сводим их в таблицу 9.
Таблица 5.2
Данные для расчета теплоемкости
|
Параметр |
бутан |
водород |
1,3-бутадиен |
|
DH298 (кдж/моль) |
-124,7 |
0 |
111,9 |
|
a (дж/моль К) |
0,469 |
27,28 |
-2,96 |
|
b 103 (дж/моль К) |
385,38 |
3,26 |
340,08 |
|
c 106 (дж/моль К) |
-198,88 |
-223,7 |
|
|
d 109 (дж/моль К) |
39,97 |
56,53 |
|
|
c’ 10-5 (дж/моль К) |
0,502 |
Рассчитываем тепловой эффект реакции при T=2980К
DH298 = 111,9 + 2´0 – (-124,7) = 236,6 кдж/моль
Далее находим сумму соответствующих коэффициентов
Dа = -2,96+2´27,28 - 0,469 =51,131
Db´103 = 340,08 +2´3,26 - 385,38 = -0,03878
Dс´106 = -223,7 + 2´0 – (-198,88)= - 24,82
Dd´109= 56,53+ 2´0 - 39,97 = 16,56
Dc’´10-5= 2´0,502= 1,004
тогда по формуле (70):
DHТ2 = DHТ1 + Dа (Т2 -Т1) + 0,5 Db (Т22 -Т21) + 1/3 Dс (Т32 -Т31) +.0,25 Dd (T42-T41) - Dс’.(T-12-T-11).
находим искомую величину
DH873 = 236600 + 51,131 (873 -298) + 0,5 (-0,03878) 10-3 (8732 -2982) + +1/3 (- 24,82) 10-6 (8733 - 2983) + 0,25´16,56-9 (8734 – 2984) – 1,004 105 (1/873-1/298) = 236600 + 29400,325 - 0,5´13055,772 - 1/3 5285,626+ +0,25´2329,05989 + 221,90702= 250210 дж/моль= 250,25 кдж/моль.
Энергетические (тепловые) балансы химических аппаратов
Энергетический (тепловой) баланс любого реактора (аппарата) может быть представлен в виде уравнения, связывающего приход и расход тепла.
S Q приход = S Qрасход
Тепловой баланс рассчитывается по данным материального баланса с учетом тепловых эффектов химических реакций и физических превращений (фазовые переходы).
Qт + Qж + Qг + Qф + Qр = Qт1 + Qж1 + Qг1 + Qф1 + Qр1+ Qа1 + Qп1 (81)
где: Qт; Qж; Qг;Qт1; Qж1; Qг1- количество тепла, вносимого и уносимого, с твердыми, жидкими и газообразными веществами.
Qф, Qф1-теплоты физических процессов, происходящих с выделением и поглощением тепла, соответственно (испарение, конденсация, возгонка, плавление, кристаллизация, абсорбция, растворение и т. д.),
Qр, Qр1- теплота экзо- и эндотермических основных и побочных реакций, Qа1-тепло, необходимое для нагрева аппарата при периодическом проведении процесса,
Qп1 - потери теплоты в окружающую среду.
Для аппаратов непрерывного действия тепловой баланс обычно составляется на единицу времени (кал/час; дж/час), а для периодических аппаратов на время цикла или отдельной операции.
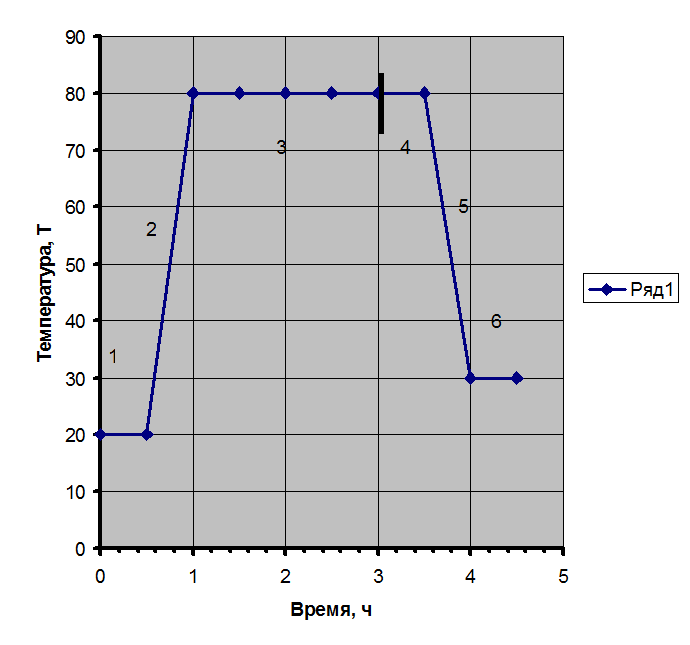
1. Загрузка
2. Нагрев
3. Реакция
4. Отгон
5. Охлаждение
6. Выгрузка
Величины Qт; Qж; Qг; Qт1; Qж1; Qг1 рассчитываются для каждого потока, входящего и выходящего из аппарата, по формуле
Qх = G*C*DT (82)
В случае непрерывных процессов, базовая температура принимается равной нулю. Если материальный поток состоит из нескольких компонентов, то используются формулы
Qх = T *SGi*Ci или Qх = G*Cсм*Т (83)
где: Gi, Ci- количество и теплоемкость каждого компонента смеси, G, Cсм - количество и средняя теплоемкость потока.
Суммарная теплота фазовых переходов, сопровождаю-щихся выделением и поглощением тепла (учитывается соответствующим знаком), рассчитывается по уравнению
Qф = SGi*r1 + SGi*r2 + SGi*r3 +..... (84)
где: Gi- массовый расход компонентов смеси, претерпевших фазовые переходы в данном аппарате, r1, r2, r3-теплоты соответствующих фазовых переходов.
Расходы теплоносителя можно рассчитывать по формулам:
Gт = Q/(Степлоносителя*(Тначаль- Тконечная)) = Q/r
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.