Разность этих двух величин (Ср—Сv) равна работе расширения системы при изменении температуры на один градус, производимой в результате подвода дополнительного тепла.
Для идеального газа Ср—Сv = R.
Для неидеальных газов при небольших давлениях и температурах можно пользоваться формулой
Ср—Сv = R(1 + 2*a*p/(R2*T2)) (38)
где а—постоянная в уравнении Ван-дер-Ваальса.
Зависимость теплоемкости от температуры.
Теплоемкость газов и паров сильно зависит от температуры.
Например, зависимости истинной и средней мольной теплоемкостей при постоянном давлении можно записать так (соответственно):
Для неорганических веществ
Ср = а + b T + с¢’Т-2.
Для органических веществ:
Ср = а + b10-3T + с 10-6T2+d10-9T3
где a, b, c, d, с¢’-коэффициенты температурной зависимости теплоемкости для данного вещества.
При расчетах на ПК, например в Excel, выгоднее пользоваться объединенной формулой
Ср = а + b T + с T2+ d T3 + с¢’Т-2
При этом для органических веществ коэффициент с¢’ будет равен нулю, а для органических веществ наоброт коэффиценты с и dбудут равны нулю.
Следует иметь в виду, что в уравнении постоянная а не является теплоемкостью вещества при Т=0°С.
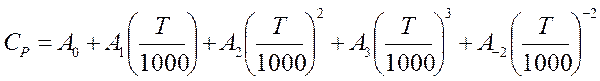
Зависимость СР от давления для реальных газов более сложна и в инженерных расчетах высчитывается по различным приближенным уравнениям.
Пример.
Найти теплоемкость паров метанола при 357 0С.
|
Вещество |
∆Нf,298кдж/моль |
S298, дж/моль град. |
Теплоемкость, дж/моль град |
C° р, 298 дж/моль-град |
|||
|
Коэффициенты уравнения Ср=f (Т) |
|||||||
|
а |
b*103 |
c*106 |
d*109 |
||||
|
СН4О (ж.) метиловый спирт |
-238,7 |
126,7 |
__ |
__ |
__ |
__ |
81,6 |
|
СН4О (г.) метиловый спирт |
-201,2 |
239,7 |
15,28 |
105,2 |
-31,04 |
-- |
43,9 |
Ср = а + b*T + с*T2+ d*T3 + с’Т-2.
где a, b, c, d—коэффициенты температурной зависимости теплоемкости для данного вещества.
Ответ.
Т=357+ 273= 630
Ср = а + b*T + с*T2+ d*T3 + с’Т-2.
Ср = 15,28 + 105,2 10-3*630 + (-31,04 10-6)*6302= 69,23 дж/моль град
Мметанола=12+16+4=32
32 грамма (1моль) имеет 69,23 дж/моль град
1000 грамм (кг) имеет х
х=1000*69,23/32=2163 дж/кг град=2,16 кдж/кг град
Теплоемкость смесей
Как правило, в промышленности материальные потоки представляют собой смеси веществ. Для таких гомофазных потоков теплоемкость смеси можно вычислить по следующим формулам:
Удельная теплоемкость раствора:
С= С1*Х1 + С2*Х2 + С3*Х3 +.....+Сп*Хп (63)
где: С1, С2, С3, Сп - удельные теплоемкости компонентов смеси, Х1, Х2, Х3, Хп - массовые доли компонентов смеси.
Для двухкомпонентных разбавленных водных растворов (Х<0,2) теплоемкость можно рассчитать по формуле:
С = 4190*(1-Х) (64)
где: 4190- удельная теплоемкость воды (дж/кг К), Х- массовая доля растворенного вещества.
Для концентрированных водных растворов (Х>0,2)
С= С1*Х1 + 4190*(1-Х1) (65)
где: С1-удельная теплоемкость безводного растворенного вещества, Х 1-массовая доля этого вещества.
Более удобно определять теплоемкости смеси по закону аддитивности:
С = (С1G1 +С2G2 +С3G3)/(G1 +G2 + G3) (67)
где: G1, G2, G3-количество вещества, С1, С2, С3-соответсвующие им теплоемкости
ТЕПЛОВЫЕ ЭФФЕКТЫ РЕАКЦИЙ
Химические процессы протекают с выделением или поглощением тепла, которое называется теплотой процесса (реакции). Всякая химическая реакция сводится к разрушению ряда связей между атомами в исходных молекулах и образование новых связей в молекулах продукта.
Если энергия, выделяющиеся при образовании новых связей больше энергии, затрачиваемой на разрушение связей в исходных молекулах, то реакция сопровождается выделением тепла (экзотермический процесс). Если же наоборот, то система поглощает энергию из окружающей среды (эндотермический процесс).
Изменение внутренней энергии (dU) при химической реакции происходит согласно 1-му закону термодинамики, за счет поглощения (или выделения) теплоты (dQ) и совершения работы (dA)
dU = dQ - dA
Изменения внутренней энергии в результате химической реакции не зависит от пути протекания реакции, а зависит лишь от начального и конечного состояния системы. Теплота реакции в общем случае не является изменением функции состояния, и, следовательно, зависит от пути процесса.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.