8. Виміряти об’єм води у бюретці. Для цього, опускаючи лійку, встановити на одній висоті рівень води в бюретці і в лійці; тоді в приладі встановлюється тиск, рівний тиску зовнішнього повітря. Записати рівень води у бюретці (V2).
Запис спостережень :
1. Маса металу (m Mg), 0,04 г.
2. Об’єм утвореного водню VH2 , мл; VH2 = V2 - V1 .
3. Температура досліду t, oC .
4. Абсолютна температура Т, К (Т = t + 273) .
5. Атмосферний тиск Р атм, мм рт. ст.
6. Тиск насиченої водяної пари при температурі досліду, РН2О, мм рт. ст. (брати з таблиці)
7. Парціальний тиск водню Р; Р = Р атм - РН2О ;
Температура, °С Тиск, Температура, °С Тиск,
![]()
![]()
![]() мм рт.ст. мм рт.ст.
мм рт.ст. мм рт.ст.
10 9,21 18 15,48
11 9,84 19 16,48
12 10,52 20 17,54
13 11,23 21 18,65
14 11,99 22 19,83
15 12,79 23 21,07
16 13,63 24 22,33
17 14,53 25 23,78
Згідно з одержаними даними розрахувати еквівалентну масу магнію.
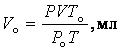 |
|||
2. Визначення маси витиснутого водню:
1000 мл Н2 мають масу 0,09 г
Vo мл Н2 - m , г
3. Визначення еквівалентної маси магнію:
а) виходячи з закону еквівалентів:
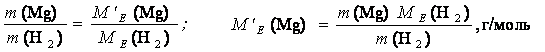 |
б) виходячи з еквівалентного об’єму водню:
m (Mg) витискує Vо мл Н2
M˝Е ( Мg) - 11200 мл Н2
4. Визначення середнього експериментального значення і теоретичного значення еквіваленту магнія:
![]()
Лабораторна робота № 4
КОМПЛЕКСНІ СПОЛУКИ
Мета роботи: вивчення комплексоутворення, складу, будови і властивостей комплексних сполук.
Дослід 1. Одержання амінкомплексу купруму (ІІ).
Комплексні сполуки, в яких лігандами є молекули амоніаку, називаються амінкомплексами.
Налити в пробірку 1-2 мл розчину CuSO4 і додати розбавлений розчин амоніаку до утворення блакитного осаду. Потім додати надлишок амоніаку (декілька крапель концентрованого розчину) до утворення синього розчину амінкомплексу купруму [Cu(NH3)4]SO4.
В даній сполуці комплексоутворювачем є іон купрум Cu2+, лігандами - молекули амоніаку NH3. Координаційне число Cu2+ дорівнює 4, іон Cu2+ приєднує чотири молекули амоніаку і утворює комплексний іон [Cu(NH3)4] 2+, заряд якого складається із заряду комплексоутворювача і лігандів: +2 + (0 . 4) = +2. Молекула електронейтральна, тому зовні знаходиться один аніон SO42-.
Написати рівняння реакції одержання осаду купрум гідроксиду і розчину амінкомплексу купруму.
Досліди 2-4 і завдання виконуються згідно з варіантами, визначеними на робочих місцяx.
Варіант 1.
Дослід 2. Електролітична дисоціація комплексних сполук.
Розчин амінкомплексу купруму поділити на дві частини. До однієї додати дві-три краплі розчину барій хлориду, щоб визначити присутність іонів SO42-. До другої частини додати 2-3 краплі розчину лугу NaOH, щоб визначити відсутність іонів купруму. Записати рівняння реакцій, свої спостереження і пояснення до них. Виходячи з дослідів, напишіть, які іони утворюються при дисоціації комплексної сполуки по першому ступеню.
Дослід 3. Одержання комплексної сполуки феруму (ІІ).
До пробірки з трьома-чотирма краплями розчину ферум сульфату FeSO4 додати дві-три краплі розчину K3[Fe(CN)6] . Спостерігати утворення синього осаду KFe[Fe(CN)6]. Скласти рівняння реакції. У комплексній сполуці KFe[Fe(CN)6] визначити заряд комплексного іона і лігандів, координаційне число і заряд комплексоутворювача.
Дослід 4. Одержання гідроксокомплексів цинку (ІІ) і xрому (ІІІ).
Комплекси, в яких лігандами є іони OH-, називаються гідрокcо-комплексами. У дві пробірки помістити кілька крапель розчинів солей Zn2+ та Сr3+, додати до них 2 – 3 краплі розбавленого розчину лугу NaOH і спостерігати утворення осадів. Добуті осади розчинити в надлишку реактиву, додавши до них кілька крапель концентрованого розчину лугу. Записати реакції утворення гідроксокомплексів, вважаючи, що координаційне число Zn2+ дорівнює 4, а Cr3+ - 6.
Завдання. Розглянути будову комплексного іону [Fe(H2O)6]3+ згідно з методом валентних зв’язків. Визначити донор і акцептор електронів.
Варіант 2.
Дослід 2. Одержання амінкомплексу аргентуму (І).
Налити в пробірку 1 мл розчину AgNO3і додати кілька крапель розчину NaCl. Спостерігати утворення білого осаду AgCl. Потім прилити концентрований розчин амоніаку. При цьому спостерігати розчинення осаду і утворення розчину комплексної солі аргентуму. Записати рівняння реакцій, враxовуючи, що координаційне число Ag+ дорівнює 2. Розчин амінкомплексу аргентуму використати для виконання досліду 3.
Дослід 3. Дисоціація комплексних солей аргентуму (І).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.