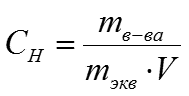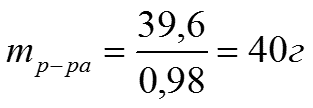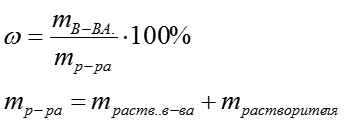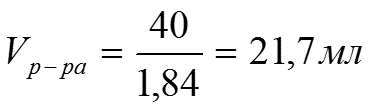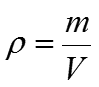Растворы
«Вода стоит особняком
в истории нашей планеты.
Нет природного тела, которое
могло бы сравниться с ней
По влиянию на ход основных
самых грандиозных процессов.»
В.И. Вернадский.
Роль растворов в природе.
¾ земного шара занимает вода
97% воды приходится на океаны и моря
3% на озёра, реки, подземные воды
животные организмы содержат до 70%
плоды огурца, арбуза содержат 90%
массы тела человека содержит 65%
2
-
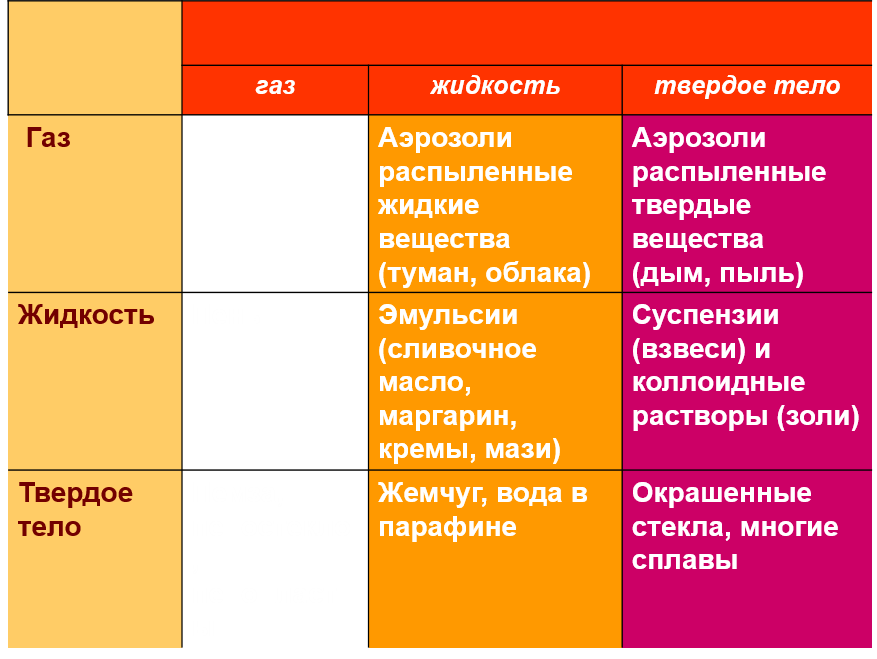
Гомогенные смеси веществ переменного состава называются растворами.
-
Компонент раствора, концентрация которого выше других компонентов, является растворителем.
-
Растворитель сохраняет свое фазовое состояние при образовании раствора.
-
Различают газовые, жидкие и твердые растворы.
3
Классификация растворов по агрегатному состоянию
4
ИСТИННЫЕ РАСТВОРЫ
-
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
5
-
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
6
КОНЦЕНТРАЦИИ РАСТВОРОВ
-
К безразмерным концентрациям (долям) относятся следующие концентрации:
-
Массовая доля растворенного вещества W(B) выражается в долях единицы
-
или в процентах:
-
где m(B) и m(A) – масса растворенного вещества B и масса растворителя A.
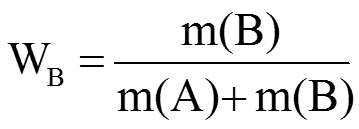
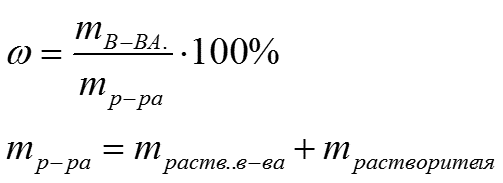
7
2. Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах:
-
(доли) или %
-
где Vi – объем компонента раствора, V(B) – объем растворенного вещества B.
-
Объемные проценты называют градусами.
-
Иногда объемная концентрация
-
выражается в тысячных долях (промилле,‰)
-
или в миллионных долях (млн–1), ppm.
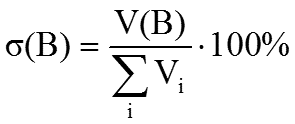
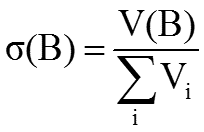
8
3. Мольная доля растворенного вещества χ(B) выражается соотношением:
-
Сумма мольных долей компонентов раствора равна единице.
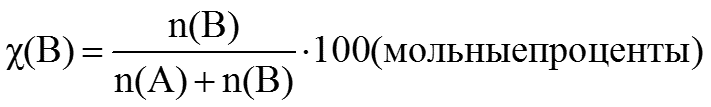
9
К размерным концентрациям относятся следующие концентрации: 1. Молярная концентрация
Молярная концентрация или молярность
(См ) показывает число моль растворимого
вещества в 1 л раствора (М) моль/л:
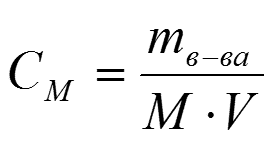
1М раствор Н2SO4 содержит 98 г/моль кислоты в 1 л раствора
10
2. Эквивалентная концентрация или нормальность (N)
Эквивалентная концентрация или нормальность
(N или Сн ) показывает количество эквивалентных
масс растворенного вещества в 1 л раствора ,
моль/л:
1н раствор Н2SO4 содержит 49 г/моль кислоты в
1 л раствора
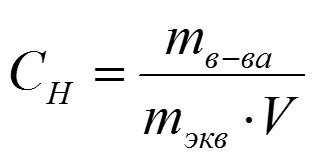
11
3. Титр (Т)
-
Титр (Т) показывает число грамм растворенного вещества в 1 мл или в 1 см3 раствора
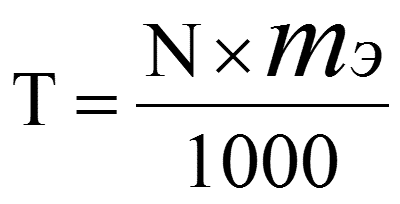
12
4. Моляльная концентрация
Моляльная концентрация или моляльность
(Сm ) показывает число моль растворимого
вещества в 1 кг или 1000 г раствора
моль/кг:
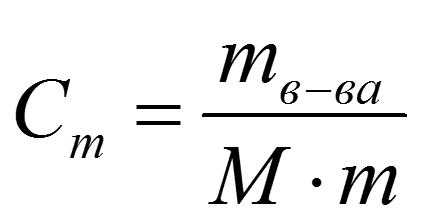
13
Задача 1. Определить M, N, T и ω раствора, содержащего 18 г H3PO4 в 300 г H2O (ρ Н3РО4 =1,031 г/см3).
Решение:
1)Найдем массовую долю растворенного вещества:
2) Найдем массу 1 л раствора (Н3РО4):
m =1000 · ρ = 1000 · 1,031 = 1031 г
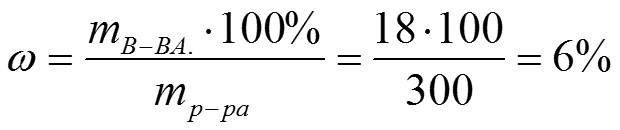
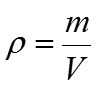
14
-
3) Нейдем массу растворенного вещества в 1 л раствора
-
г
-
4) М (Н3РО4) = 3 + 31 + 64 = 98 г/моль mэ(Н3РО4) =32,7 г/моль
-
5) Молярность: См = моль/л
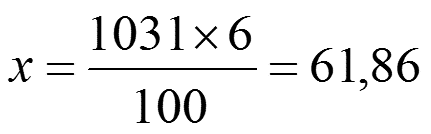
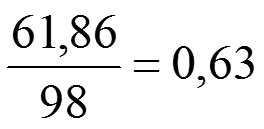
15
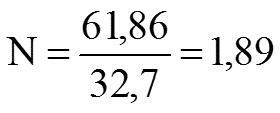
-
6) Нормальность:
-
7) Титр: Т =
моль/л
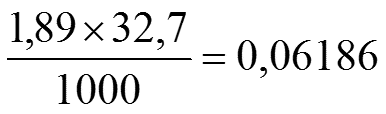
г/мл
16
Задача 2: Какой объем 98% Н2SO4 c ρ= 1,84 г/см3 потребуется для приготовления 2л 0,4н раствора.
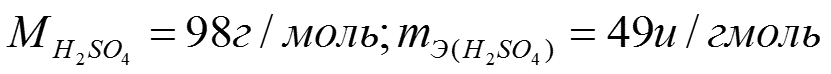
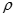
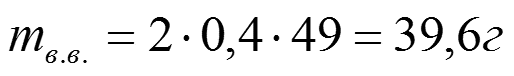


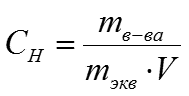
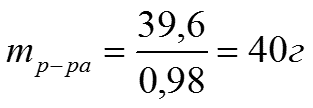
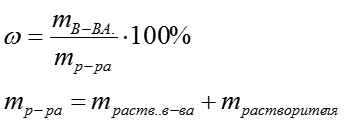
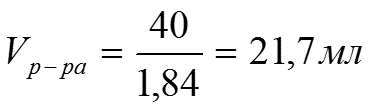
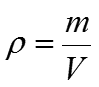
17
Гидраты и кристаллогидраты
-
Установлено, что в водном растворе происходит образование гидратов (для неводных растворов – сольватов), которые являются сравнительно непрочными соединениями растворенных частиц и растворителя.
-
В зависимости от природы растворенного вещества, сольваты могут образовываться различными путями
18
-
1) При растворении веществ с полным типом связи между молекул растворителя и ионами растворенного вещества возникают ион-дипольное взаимодействие
19
-
2) Между ионами растворенного вещества и молекулами растворителя возможно и донорно-акцепторное взаимодействие, если молекулы растворителя обладают неподеленными парами электронов (H2O, NH3). Ионы растворенного вещества выступают в качестве акцепторов. Образуются комплексные соединения аквакомплексы – если растворитель Н2О, аммиакаты – если растворителем является NH3
20
-
3) При растворении веществ с полярно ковалентным типом связи сольваты образуются за счет диполь-дипольного взаимодействия.
21
-
Гидраты в большинстве случаев – нестойкие соединения, разлагающиеся при нагревании.
-
При этом некоторые гидраты настолько прочны, что молекулы воды входят в состав его кристаллов. Такие вещества называют кристаллогидратами, а вода, содержащаяся в них, называется кристаллизационной.
-
Пример: CuSO4 · 5H2O – медный купорос
-
Na2SO4 · 10H2O – глауберова соль
-
CaSO4 · 2H2O – гипс
22
Растворимость Растворимость твердых веществ в жидкости
-
Растворимость – количество растворимого вещества в граммах способное растворится при данной температуре в 100 г растворителя.
-
Если растворяется:
-
> 10 г в 100 г Н2О – хорошо растворяется (Р),
-
< 1 г – малорастворимо (М),
-
< 0,01г - нерастворимо (Н)
-
Процесс растворения сопровождается тепловым эффектом.
23
-
Если энергия, которую надо затратить на разрушение кристаллической решетки твердого тела, больше энергии сольватации, то процесс растворения протекает с поглощением теплоты. (С повышением температуры растворимость усиливается.),
-
если - меньше энергии сольватации, то процесс растворения протекает

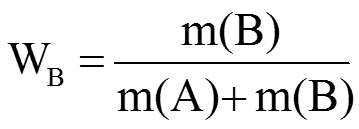
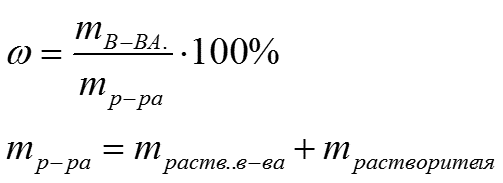
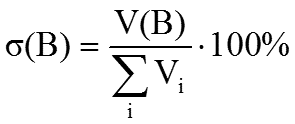
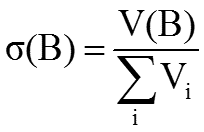
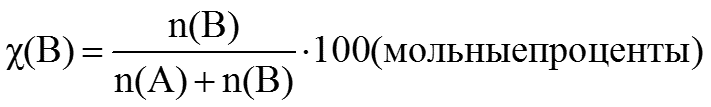
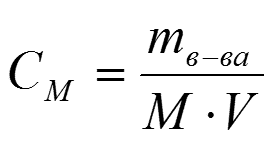
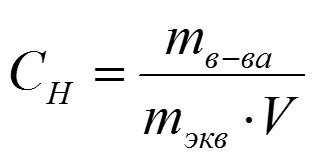
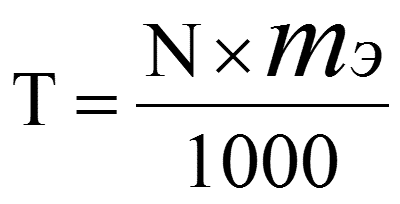
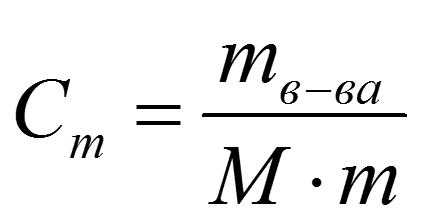
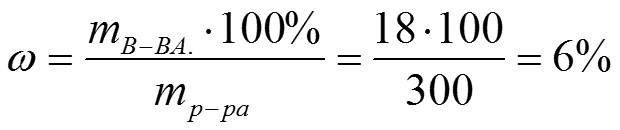
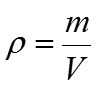
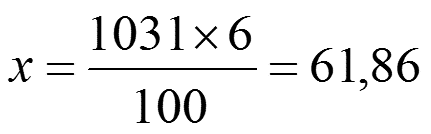
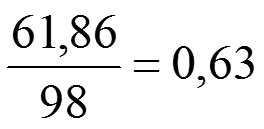
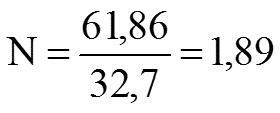
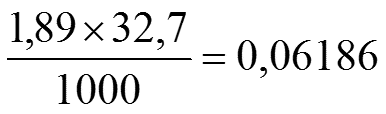
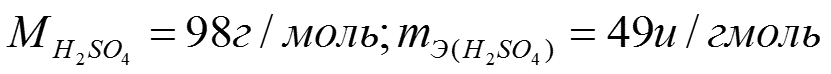
![]()
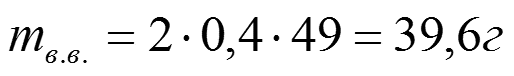
![]()
![]()