ЛЕКЦИЯ 14
Гетерогенные коллоидные системы и их получение. Строение коллоидных частиц. Агрегативная и кинетическая устойчивость систем. Коагуляция. Эмульсии. Суспензии.
КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные частицы имеют весьма малые размеры (см. табл. 11.1) и поэтому участвуют в броуновском движении, в то же время они обладают заметной скоростью диффузии (10-1 ¸ 10-3 см2/с), что способствует выравниванию концентрации частиц по объему. Кроме того, если раздробить 1 см3 вещества до размера коллоидной частицы, то суммарная площадь всех граней дисперсной фазы составит от 60 до 600 м2. В этом случае частицы приобретают избыточную энергию, вследствие чего увеличивается адсорбция. Коллоидные растворы – принципиально неустойчивые системы. Они стремятся к самопроизвольному уменьшению межфазной поверхности, то есть к снижению дисперсности.
Свойство коллоидных систем увеличивать размер частиц путем их агрегации называется агрегативной неустойчивостью. Агрегативная неустойчивость преодолевается путем адсорбции ионов или молекул на частицах дисперсной фазы, за счет чего на границе раздела фаз формируется скачок потенциала. Благодаря этому коллоидные системы обладают весьма высокой агрегативной устойчивостью, что при малых размерах частиц способствует седиментационной[*] устойчивости, так как гравитационная сила, вызывающая седиментацию, нивелируется силами диффузии.
 По характеру взаимодействия
дисперсной фазы и дисперсионной среды коллоидные растворы можно подразделить на
лиофобные (частицы дисперсной фазы практически не взаимодействуют с
дисперсионной средой) и лиофильные коллоиды (растворы высокомолекулярных
соединений), которые могут образовываться самопроизвольно, благодаря сильному
взаимодействию дисперсной фазы и дисперсионной среды. Они способны сохранять
агрегативную устойчивость без стабилизатора в двухкомпонентном растворе.
Лиофильные системы термодинамически устойчивы (ΔG≤0) и характеризуются
самопроизвольным диспергированием. Так, мыла и многие глины (например, бентонитовая)
самопроизвольно «распускаются» в воде, а ВМС растворяются в «хорошем»
растворителе до отдельных макромолекул и представляют собой истинные растворы.
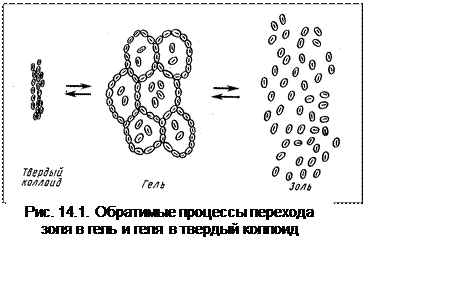
При длительном хранении гидрофильные золи переходят в гели. Структура геля
такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя
своеобразные ячейки, внутри которых сохраняются молекулы воды. Гель можно
высушить, превратив его в твердый коллоид (рис. 14.1).
По характеру взаимодействия
дисперсной фазы и дисперсионной среды коллоидные растворы можно подразделить на
лиофобные (частицы дисперсной фазы практически не взаимодействуют с
дисперсионной средой) и лиофильные коллоиды (растворы высокомолекулярных
соединений), которые могут образовываться самопроизвольно, благодаря сильному
взаимодействию дисперсной фазы и дисперсионной среды. Они способны сохранять
агрегативную устойчивость без стабилизатора в двухкомпонентном растворе.
Лиофильные системы термодинамически устойчивы (ΔG≤0) и характеризуются
самопроизвольным диспергированием. Так, мыла и многие глины (например, бентонитовая)
самопроизвольно «распускаются» в воде, а ВМС растворяются в «хорошем»
растворителе до отдельных макромолекул и представляют собой истинные растворы.
При длительном хранении гидрофильные золи переходят в гели. Структура геля
такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя
своеобразные ячейки, внутри которых сохраняются молекулы воды. Гель можно
высушить, превратив его в твердый коллоид (рис. 14.1).
Все процессы обратимы:
золь « гель « твердый коллоид.
СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ
В основу современных представлений о строении коллоидных частиц легли работы российских ученых А.В. Думанского, Н.П. Пескова, С.М.Липатова, А.Н. Фрумкина, а также зарубежных исследователей Паули, Фаянса, Кройта и других. Строение коллоидных частиц удобнее рассматривать, если проследить процессы образования частиц на примере образования коллоидной частицы AgI:
Молекулы AgI объединяются в практически нерастворимые частицы, в которых ионы Ag+ и I- образуют кристаллическую решетку. Если AgNO3 и KI взяты в эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI. При избытке AgNO3 в растворе будут находиться ионы Ag+ и NO3–. Построение кристаллической решетки AgI, согласно правилу Панета-Фаянса, может идти только за счет ионов, входящих в ее состав, в данном случае – за счет ионов Ag+. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, входя в его структуру и сообщая ему электрический заряд (рис. 14.2-1), определяющий так называемый электротермодинамический потенциал. В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами (рис. 14.2-IIб). Величина электротермодинамического потенциала (φ или E-потенциала) у многих коллоидных частиц достигает 1 В. Частицы с таким высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3- (противоионы) (рис. 14.2-IIa).
В процесс адсорбции противоионов устанавливается динамическое
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.