![]()
где dmldr - скорость выщелачивания, моль/с; К - константа скорости химической реакции; S - площадь реакционной поверхности, см2; С - концентрация реагента в растворе, моль/см3; n- порядок реакции.
Если самая медленная стадия - скорость диффузии (скорость подвода реагента к реакционной поверхности), 'то; процесс протекает в диффузионной, области и скорость всего процесса определяется законами диффузии. Скорость процесса выщелачивания, про такающего в диффузионной области, в молях в секунду определяется уравнением
![]()
где D- коэффициент диффузии, см2/с; δД - толщина диффузионного слоя, см..
Для того чтобы определить, в каком режиме протекает изучаемый процесс, необходимо располагать объективными критериями, которые позволяли бы на основании экспериментальных данных судить о характере стадии, контролирующей скорость всего процесса.
Наиболее надежным критерием может служить: влияние условий перемешивания па. скорость процесса. Так, увеличение скорости процесса с повышением интенсивности перемешивания свидетельствует о том, что процесс протекает в диффузионной области. Напротив, независимость скорости процесса от условий перемешивания указывает на кинетический режим процесса.*
Другим критерием протекании процесса выщелачивания в диффузионной или кинетической области может служить характер изменения скорости процесса от температуры. Скорость химической реакции растет с повышением температуры гораздо быстрее скорости диффузии.
Количественное влияние температуры на скорость химической реакции выражается уравнением Аррениуса
![]()
где К- константа скорости химической реакции; К0 - константа; Е - энергия активации химической реакции, Дж/моль; R- универсальная газовая постоянная, R= 8,31 Дж/(моль* К); Т- абсолютная температура, К.
Как следует из уравнения (3), скорость реакции изменяется с температурой тем сильнее, чем больше значение E. Для большинства химических реакций, протекающих на границе: твердое тело - раствор, энергия активации превышает 35 к Дж/моль.
Подставив уравнение (3) в уравнение (1), получим зависимость скорости процесса выщелачивания в кинетической области от температуры
![]()
Скорость диффузионных процессов также зависит от температуры. Однако в этом случае зависимость намного меньше; энергия активации диффузионных процессов имеет небольшое значение, порядка 8-20 кДж/моль.
Естественно, что наиболее достоверные сведения о характере контролирующей стадии можно получить, если оба критерия использовать совместно.
![]()
Целью настоящей работы является экспериментальное определение энергии активации процесса выщелачивания твердой окиси меди раствором серной кислоты
Для определения энергии Е прологарифмируем уравнение (4):
Lgv=lgA-E/2,3RT, (5)
Ult v=dm/dr, A=K0SCn.
Уравнение (5) - это уравнение прямой линии в координатах lgv-1/T, тангенс угла наклона которой к оси абсцисс равен E/2,3R. Cследовательно, для определения необходимо экспериментально определить скорость процесса при нескольких отличающихся температурах (при прочих одинаковых условиях), построить график в координатах lgv- 1/Tи рассчитать искомую величину по формуле
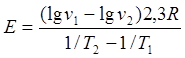
в которой значения lgv1, lgv2 , 1/T1, и 1/T2 берут из графика.
Процесс выщелачивания используется, например, в широко известном способе Мостовича, предложенном для переработки смешанных медных руд. Б таких рудах медь наряду с хорошо флотируемыми сульфидными минералами представлена практически нефлотируемыми окисленными минералами. Поэтому по способу Мостовича такие руды сначала обрабатывают раствором серной кислоты для перевода меди и окисленных минералов в раствор. Затем в пульпу добавляют металлическое железо для цементации растворенной меди. Образующаяся цементная медь потом хорошо флотируется вместе с сульфидными минералами.
Порядок выполнения работы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.