5.4. ОСОБЕННОСТИ РАСТВОРЕНИЯ ВЕЩЕСТВ,
СВЯЗАННЫЕ С ИХ АГРЕГАТНЫМ СОСТОЯНИЕМ
5.4.1. Взаимная растворимость жидкостей
Возможны три случая взаимной растворимости жидкостей:
1. жидкости смешиваются друг с другом в любых соотношениях, образуя однородную, однофазную систему (вода + этиловый спирт);
2. обладают ограниченной взаимной растворимостью (вода + эфир);
3. практически нерастворимы друг в друге (вода+ртуть)
Первый случай представляет собой один из вариантов образования истинного раствора. Он не имеет особых специфичных свойств, поэтому здесь разбираться не будет. Определенный интерес представляет случай с ограниченной растворимостью жидкостей.
При смешивании малорастворимых друг в друге жидкостей образуется неустойчивая эмульсия, которая после некоторого отстаивания образует два слоя из насыщенных растворов. Для нашего примера это будут: внизу слой воды насыщенный эфиром и сверху слой эфира, насыщенный водой. Взаимная растворимость таких жидкостей зависит от температуры, повышение которой может привести к неограниченному смешиванию этих жидкостей. Проанализировать влияние температуры на взаимную растворимость жидкостей можно с помощью кривой расслоения. Общий вид кривой расслоения для ограниченно растворимых друг в друге жидкостей А и В показан на рис. 5.6.
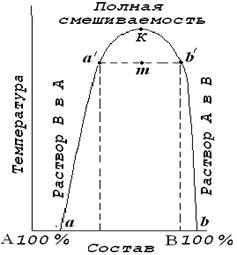 Рис.
5.6. Диаграмма взаимной растворимости жидкостей А и В при различных
температурах.
Рис.
5.6. Диаграмма взаимной растворимости жидкостей А и В при различных
температурах.
Кривые аа′К и Кb′b представляют собой кривые взаимной растворимости жидкостей (их называют также кривыми расслоения): В в А и А в В соответственно. Обе кривые сходятся в точке К, которая отвечает некоторой критической температуре растворения этих жидкостей. Область, находящаяся выше этой точки, представляет собой зону, где жидкости неограниченно смешиваются между собой. Любые точки, расположенные вне области аа′Кb′b отвечают гомогенным ненасыщенным растворам. Точки, находящиеся внутри области аа′Кb′b, соответствуют системе, состоящей из двух слоев растворов, составы которых в свою очередь определяются точками пересечения соответствующей изотермы с кривой аа′Кb′b. Например, смесь состава m будет расслаиваться на насыщенные растворы, составы которых отвечают точкам а′ и b′.
5.4.2. Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит главным образом от природы газа и жидкости, температуры и давления. Хорошо растворяются газы способные образовывать химические соединения с растворителем. В противном случае газы растворяются слабо или не растворяются вообще, как например, фтористый азот (NF3). В таблице 5.4 приведены некоторые примеры плохой и хорошей растворимости газов в воде.
Таблица 5.4
Растворимость газов в воде при давлении101325 Па
[Рабинович В.А., Хавин З.Я. Краткий химический справочник. "Химия", Л.-1977- 376 с.]
|
Температура оС |
Растворимость, мл/100 г (Н2О) (Взаимодействие с водой усиливается ®) |
||||||||
|
Не |
Н2 |
N2 |
O2 |
Kr |
СО2 |
HCl |
NH3 |
Cl2 |
|
|
0 |
0,97 |
2,15 |
2,35 |
4,89 |
11,0 |
171,3 |
82,3 |
87,5 |
461 |
|
10 |
0,99 |
1,95 |
1,86 |
3,80 |
119,4 |
67,9 |
- |
||
|
25 (30)* |
(1,00) |
1,75 |
1,43 |
2,83 |
6,0 |
75,9 |
(67,3) |
46,25 |
202 |
|
40 |
- |
1,64 |
1,18 |
2,31 |
2,5 |
53,0 |
63,3 |
30,7 |
144 |
|
50 |
1,07 |
1,61 |
1,09 |
2,09 |
4,67 |
43,6 |
59,6 |
22,9 |
- |
При анализе этой таблицы обращают внимание две особенности:
· растворимость газов падает с увеличением температуры;
· чем прочнее связи между водой и молекулами газа, тем выше его растворимость.
Первую особенность можно легко наблюдать при кипячении воды. Пузырьки газа образуются на дне посуды, где происходит нагревание жидкости. В этом случае имеется и исключение. Для гелия просматривается, хоть и слабо выраженная, но обратная зависимость.
Растворение газов обычно протекает с выделением теплоты. Поэтому при повышении температуры равновесие естественно смещается в сторону эндотермического процесса, что и объясняет уменьшение растворимости газа с повышением температуры[1].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.