ТИПОВОЙ ПРИМЕР
· Рассчитайте массу азота, которая помещается в газовый баллон емкостью 0,1 м3 при 293 К под давлением 5∙106 .
Решение
Принимаем. что газ идеальный. Массу такого газа нетрудно определить из уравнения состояния идеального газа: pV = nRT = mRT/M .
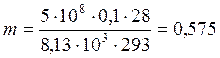 кг
кг
· Плотность водного раствора Na2CO3 с массовой долей равной 16 %, составляет r = 1,17∙103 кг/м3. Выразите состав раствора в молярных долях и рассчитайте молярную концентрацию.
Решение
Рассчитываем число молей растворенной соли (n1) и воды (n2) в 100 кг раствора:
n1 = 16/106= 0,15 кмоль и n2 = 84/18 = 4,67 кмоль
В соответствии с определением выражение для молярной доли карбоната натрия имеет вид: N(Na2CO3) = n1/( n1 + n2). Отсюда имеем:
N(Na2CO3) = 0,15/(0,15 + 4,67) = 0,031
Молярная доля воды составит
N(Н2O) = 1 – 0,031 = 0,969
100 кг 16 %- ного раствора карбоната натрия занимают объем
V = m/r = 100/(1,17∙103) = 85,47∙10-3 м3
Молярная концентрация этого раствора будет равной:
c= n1/V= 0,15/85,47∙10-3 =1,76 кмоль/ м3
ВОПРОСЫ
1. Что такое идеальный газ? Приведите основные признаки идеального газа.
2.
[*] Устойчивыми считаются те частицы, которые можно изучить физико-химическими методами
[†] Под механизмом химической реакции понимают некоторую последовательность отдельных стадий, которые можно теоретически предложить для данной реакции.
[‡] Обычно, если не оговорено особо термин растворы относят к истинным растворам, которые и будут рассматриваются в дальнейшем.
[§] От механических смесей истинные растворы отличаются своей однородностью и увеличением энтропии системы при смешивании растворителя с растворяемыми веществами.
[i]. Понятие молекулы в химии, повидимому, является центральным, т.к. многие процессы методически удобно описывать привлекая представления о молекулах и производных от них частицах. Производными от молекул частицами, в частности, являются молекулярные ионы, молекулярные радикалы (отсутствует заряд, но имеется один или два неспаренных электрона), макромолекулы полимеров, содержащие большое число повторяющихся мономеров (фрагментов молекул, обладающих одинаковыми химическими свойствами).
[ii] Картину движения молекул идеального газа можно уподобить броуновскому движению частиц (см. раздел молекулярно-кинетические свойства коллоидных систем)
[iii] Физический смысл R становится понятным при рассмотрении уравнения состояния идеального газа, записанного в форме уравнения Клапейрона: pV = mR’T и формулы, определяющей количество вещества (n): n = m/M. Здесь m масса чистого молекулярного компонента с молярной массой М; R’ -газовая постоянная.
Известно, что величина R’ различается для разных газов. Однако в соответствии с кинетической теорией газов (это впервые показал Д.И. Менделеев), произведение R’×М = R для любого газа, отвечающего свойствам идеального газа, имеет одно и то же значение. Поэтому уравнение состояния идеального газа принимает вид: pV =nRT.. Постоянная R в зарубежной литературе [8] и в последних изданиях отечественной литературы [5] получила название молярная газовая постоянная. Ее величина 8,3143 кДж/(кмоль×К).
Следует отметить, что в отечественной литературе встречаются и другие названия R. Среди них: раннее - «универсальная газовая постоянная», «универсальная молярная газовая постоянная» [5] и даже «газовая постоянная» [4]
[iv] С учетом названных признаков идеальный газ – это газ, представленный не взаимодействующими между собой молекулами бесконечно малых размеров. Можно пользоваться и другим определением идеального газа, согласно которому идеальный газ - это такой газ, состояние которого можно описать уравнением состояния, т.е.pV = nRT.
[v] Элементарная кристаллическая решетка
[vi] Изоморфные
[vii] Диэлектрическая постоянная показывает во сколько раз притяжение или отталкивание между двумя электрическими зарядами в некоторой среде меньше чем в вакууме.
[viii] "Ион" на древнегреческой означает "идущий" Термины "ион","катион" и "анион" ввел М.Фарадей, который предполагал, что эти частицы возникают в растворах под действием электрического поля.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.