Химическая коррозия является гетерогенной химической реакцией и наблюдается, в частности, при действии на металлы сухих газов, содержащихся в воздухе.
Химическая коррозия металлов возникает в агрессивных средах, не проводящих электрического тока, например, при повышении температуры в газовых средах (в воздухе, парах воды, и т. п.), при взаимодействии со многими органическими веществами (смазочными материалами, органическими растворителями и т. п.).
Первопричиной химической коррозии металлов является возможность самопроизвольного перехода металлов в более устойчивое окисленное (ионное) состояние в результате следующего процесса:
Металл + Окислительный компонент среды = Продукт реакции.
Наиболее распространенным процессом газовой коррозии металлов является реакция окисления металла кислородом, в результате которой металл покрывается пленкой окисла.
Взаимодействие металлов с коррозионной средой проявляется в адсорбции окислительного компонента среды (O2, H2O, CO2, SO2 и Cl2;) поверхностью металла. В ряде случаев пленка продуктов коррозии образуется на металле с самоторможением во времени, поскольку многие пленки обладают защитными свойствами.
Пленки продуктов коррозии на металлах принято подразделять на три группы:
1. тонкие (невидимые), толщина которых составляет 0,5…40 нм;
2. средние (дающие цвета побежалости), толщина которых - 40...500 нм;
3. толстые (видимые), толщиной свыше 500 нм (например, окалина на стали).
Защитные свойства пленки оценивают по скорости окисления металла и по характеру изменения этой скорости во времени.
Химическая коррозия металлов существенно зависит от внешних факторов, определяемых составом коррозионной среды и условиями коррозии (температурой, давлением, скоростью движения среды и т. д.) и внутренних факторов, определяемых видом металла, сплава или покрытия, характером обработки поверхности и т. д.
На скорость процессов химической коррозии металлов значительно влияет температура, с повышением которой до 500...1000°С процессы окисления металлов протекают значительно быстрее. Скорость окисления металлов определяется температурной зависимостью константы скорости химической реакции k, описываемой законом Аррениуса
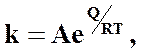
где А - постоянная, определяемая свойствами металла и коррозионной среды; Q - энергия активации химической реакции или диффузии; R – универсальная газовая постоянная; Т - абсолютная температура.
Величины А и Q определяются опытным путем. Установлено, что попеременный нагрев и охлаждение также увеличивают скорость окисления металлов. При этом, например, в защитной окисной пленке железа и сталей, вследствие термических напряжений, возникают трещины, и она может отслаиваться от металла. Большое влияние на скорость коррозии оказывает и состав газовой среды. Никель и его сплавы подвержены влиянию коррозии в атмосфереSO2; и относительно устойчивы в средеO2, H2O и CO2;. Медь быстро корродирует в атмосфереO2, но устойчива в атмосфереCO2; и т. д.
Существенное влияние на процесс ускорения химической коррозии оказывает увеличение давления окисляющих газов. Однако этот процесс в значительной степени зависит от состояния поверхности металла и от температуры среды.
Наиболее распространенной является электрохимическая (гальваническая) коррозия. Она возникает вследствие образования гальванических пар при соприкосновении (контакте) различных металлов в средах, проводящих электрический ток, т. е. в присутствии электролита (воды, водных растворов электропроводящих веществ и т. п.).
Наличие в окружающей атмосфере паров растворимых солей и кислот приводит к образованию на поверхности металла пленки электролита и возникновению электрохимической коррозии. При взаимодействии окислов металлов с водой образуются гидраты окислов, которые способствуют адсорбции влаги за счет химической конденсации.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.