С именем Больцмана связано истолкование 2-го закона термодинамики и энтропии. Он ввёл в физику статистические методы и рассмотрел распределение молекул по состояниям (координатам, импульсам, энергиям). В частности, распределение молекул по энергиям устанавливается следующей формулой:
![]() , где
, где
![]() — начальное
состояние молекул в объёме,
— начальное
состояние молекул в объёме,
![]() — постоянная
Больцмана,
— постоянная
Больцмана,
![]() — полная энергия
молекул,
— полная энергия
молекул,
![]() — температура.
— температура.
Больцман установил
некое наивероятнейшее состояние среды и связь энтропии с вероятностью состояния
![]() :
:
![]() (4)
(4)
![]() —
число способов, с помощью которых можно осуществить данное состояние.
—
число способов, с помощью которых можно осуществить данное состояние.
Физики неоднократно оспаривали эту формулу, но последующее развитие науки подтвердило её справедливость.
Пример (случай устойчивой системы)

Реализуется одно состояние:
![]()
![]() .
.
Пример ![]() — число
способов, которыми можно разместить молекулы газа в сосуде, т. е.
— число
способов, которыми можно разместить молекулы газа в сосуде, т. е. ![]() — есть мера неопределённости и
хаотичности системы.
— есть мера неопределённости и
хаотичности системы.
Постоянная
Больцмана ![]() энтропийных единиц.
энтропийных единиц.
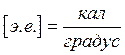 .
.
Энтропия пропорциональна массе:
![]()
![]()
![]()
![]()
![]()
Больцман фактически ответил на вопрос о физическом смысле энтропии и причинах её роста в изолированных системах. Энтропия — это мера беспорядка в системе (порядок соответствует минимуму энтропии), т. е., если система предоставлена сама себе (она изолирована), то коллектив частиц стремится перейти в состояние, в котором при данных условиях возможен полный хаос (ему соответствует максимум энтропии).
Пример В кристаллическом твёрдом теле энтропия меньше, чем в жидком.
Связь между
вероятностью состояния системы и энтропией Больцман показал на простом примере.
Известно, что ![]() , следовательно, энтропия всей
системы равна сумме составляющих. По теории вероятности вероятность данного
состояния вещества полной системы равна произведению вероятностей её составных
частей. Такими свойствами обладает
, следовательно, энтропия всей
системы равна сумме составляющих. По теории вероятности вероятность данного
состояния вещества полной системы равна произведению вероятностей её составных
частей. Такими свойствами обладает ![]() .
.
![]() (1)
(1)
Если посмотреть на биологическую систему через призму второго закона термодинамики, то на первый взгляд есть парадокс: процессы жизнедеятельности нарушают принципы термодинамики.
Система при
росте совершенствуется и упорядочивается. Однако ![]() увеличивается
необратимым самопроизвольным образом, происходящем в изолированных системах.
Биологические системы — открытые.
увеличивается
необратимым самопроизвольным образом, происходящем в изолированных системах.
Биологические системы — открытые.
Наша задача:
Главная трудность в том, что необходимо учитывать изменение всех термодинамических параметров во времени непосредственно в ходе развития процессов в открытой системе.
В 1945 Пригожин показал, что изменение энтропии в неизолированной системе, обменивающейся с внешней средой энергией и веществом, представляется в виде:
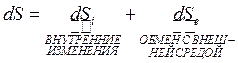 ,
,
![]() — обусловлена приростом
энтропии за счёт необратимых процессов внутри системы (производство энтропии);
— обусловлена приростом
энтропии за счёт необратимых процессов внутри системы (производство энтропии);
![]() — обусловлена происходящим
обменом с окружающей средой.
— обусловлена происходящим
обменом с окружающей средой.
Производство энтропии обусловлено диссипативными процессами (теплопроводность, диффузия, вязкость …) — процессами с рассеянием энергии.
В общем случае
![]() . Если
. Если ![]() и
превышает по модулю
и
превышает по модулю ![]() , то на определённой
стадии эволюции может происходить понижение энтропии.
, то на определённой
стадии эволюции может происходить понижение энтропии.
Справедлив постулат Пригожина:
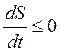 .
.
Биологами установлено, что при фотосинтезе приток энергии света приводит к уменьшению энтропии клетки, а процессы дыхания, химические реакции в клетке увеличивают энтропию.
Согласно
теории Шеннона (1949 год), количество информации ![]() о
единичном реальном состоянии системы подчиняется соотношению
о
единичном реальном состоянии системы подчиняется соотношению
![]() . (2)
. (2)
Попытаемся формально оценить количество информации, содержащейся в теле человека:
![]() бит
бит
За бит
принимается информация, содержащаяся в достоверном сообщении, когда число
исходных возможных состояний ![]() .
.
Сопоставляя
(1) и (2), можно найти связь между ![]() и
и ![]() в битах:
в битах:
![]()
![]() э. е.
э. е.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.