Mzs- проекция на заданное направление.
Полный момент электрона 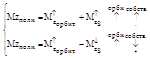
4. С у четом спина полный набор квантовых чисел есть n,l,m. Первые три связаны с движением электрона в атоме, четвертый – с собственным свойством электрона.
Полный набор собственных характеристик электрона тоже 4: E, M, Mzs, Mz.
5. Так как в каждом квантовом состоянии электрон имеет две ориентации спина, то число различных квантовых состояний, соответствующих определенному значению n будет 2n2 – принцип Паули для электрона в атоме.
6. Так как![]() зависит от квантовых чисел, смысл которых
разобран, то, следовательно, известно значение
зависит от квантовых чисел, смысл которых
разобран, то, следовательно, известно значение![]() . А,
зная
. А,
зная![]() , можно рассчитать вероятность обнаружения
электрона в атоме водорода в различных квантовых состояниях. Рис.2.
, можно рассчитать вероятность обнаружения
электрона в атоме водорода в различных квантовых состояниях. Рис.2.
Следовательно, радиусы боровских орбит соответствуют расстояниям, на которых максимальна вероятность обнаружения электрона в атоме, но электрон может быть ближе и дальше этого расстояния с меньшей вероятностью. Следовательно, движение электрона в атоме есть некое электронное облако (форму определяет l), плотность которого максимальна на расстояниях, соответствующих боровским радиусам орбит. Вкладывая такой смысл в боровские радиусы, можно сохранить понятие орбит.
7. Отличительные особенности квантовой механики: вероятность поведения частиц, и дискретность всех характеристик частиц. Рис.2.1
Твердое тело рассматривается как кристаллическое, имеющее правильную внутреннюю структуру, причем атомы и электроны образуют единую систему, в рамках которой выполняются законы квантовой механики.
Квантовые особенности.
- Для изомера атома
1. Наличие разрешающих значений энергий Е1, Е2,…,Еn образуют дискретный ряд.
2. Наличие областей запрещенных значений энергий (Е3-Е2), (Е2-Е1).
3. Так как энергия электрона в изомерном атоме зависит только от «n», то на каждом уровне может быть 2n2 разных электронов (которые будут отличаться значениями l, m). 2n2 разных электронов – принцип Паули для изомерного электрона.
4. Наличие энергетических уровней не означает обязательное заполнение их электронами.
5. На любом уровне, кроме нормального (возбужденный
уровень) электрон может находиться ![]() Это есть неопределенность
времени пребывания электрона в возбужденном состоянии.
Это есть неопределенность
времени пребывания электрона в возбужденном состоянии.
По принципу неопределенностей ![]() ,
где
,
где ![]() - неопределенность энергии электрона на
возбужденном уровне.
- неопределенность энергии электрона на
возбужденном уровне.
При графическом изображении схемы энергетических уровней![]() есть ширина энергетического уровня.
есть ширина энергетического уровня.
![]()
- Для кристалла.
1. Наличие разрешенных энергетических зон. Каждая из этих зон есть совокупность энергетических уровней, число которых равно n=N(2l+1), где N–число атомов, объединенных в кристалле, l-значение квантового числа для того уровня, из которого образуется зона.
2. Наличие запрещенных энергетических зон![]() .
.
3. Так как энергия электрона в кристалле зависит от трех квантовых чисел (n, l, m), то электроны могут отличаться только по направлению спина, поэтому на каждом уровне в зоне не может быть больше двух электронов (принцип Паули для электрона в атоме), с противоположными спинами. Следовательно, максимальное число электронов в зоне z=2N(2l+1).
4. Наличие энергетических зон не означает обязательное заполнение их электронами.
5. ![]() - неопределенное время
пребывания электрона под влиянием 1 ядра.
- неопределенное время
пребывания электрона под влиянием 1 ядра.
![]() ;
; ![]() - неопределенность энергии на перекрытых
орбитах, или, иначе это есть ширина соответствующего энергетического уровня.
Следовательно, для перекрытия электронных орбит при объединении атомов в
кристалл происходит расширение соответствующих энергетических уровней и
превращение его в энергетическую зону. Расширение энергетического уровня
(ширины энергетической зоны) будет тем меньше, чем меньше номер уровня. В
первую очередь будет расширяться валентный энергетический уровень.
- неопределенность энергии на перекрытых
орбитах, или, иначе это есть ширина соответствующего энергетического уровня.
Следовательно, для перекрытия электронных орбит при объединении атомов в
кристалл происходит расширение соответствующих энергетических уровней и
превращение его в энергетическую зону. Расширение энергетического уровня
(ширины энергетической зоны) будет тем меньше, чем меньше номер уровня. В
первую очередь будет расширяться валентный энергетический уровень.
Внутренняя структура энергетических зон.
3Li – изомер. атом
![]()
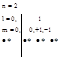
3-ий электрон атома лития в состоянии: n=2,l=0,m=0,* - 2s1, следовательно, 3 электрона атома лития находятся в состоянии: 1s22s1.
Зона 1s – в ней может быть z=2N(2l+1)=2N – полностью заполнена электронами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.