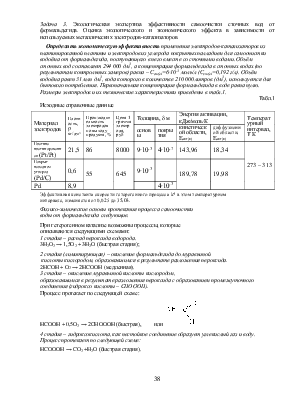











Задача 3. Экологическая экспертиза эффективности самоочистки сточных вод от формальдегида. Оценка экологического и экономического эффекта в зависимости от используемых металлических электродов-катализаторов
Определить экономическую эффективность применения электродов-катализаторов из платинированной платины и электродов из углерода покрытых палладием для самоочистки водоёма от формальдегида, поступающего в него вместе со сточными водами. Объём сточных вод составляет 294 000 дм3, а концентрация формальдегида в сточных водах (по результатам контрольных замеров) равна – Сст(в)=6∙10-3 моль/л (Сст(в)=0,192 г/л). Объём водоёма равен 31 млн дм3, вода которого в количестве 210 000 литров (дм3), используется для бытового потребления. Первоначальная концентрация формальдегида в воде равна нулю. Размеры электродов и их технические характеристики приведены в табл.1.
Табл.1
|
Материал |
Плотность, |
Производительность электродов по выходу продукта, % |
Цена 1 грамма электрода, руб |
Толщина, d м |
Энергия активации, кДж/моль∙К |
Температурный интервал, Т К |
||
|
основы |
покрытия |
кинетической области, Еакт(к) |
диффузионной области, Еакт(к) |
|||||
|
Платина |
21,5 |
86 |
8000 |
9∙10-3 |
4∙10-7 |
143,96 |
18,34 |
273 – 313 |
|
Покрыт паладием углерод (Pd/С) |
0,6 |
55 |
645 |
9∙10-3 |
|
189,78 |
19,98 |
|
|
Pd |
8,9 |
4∙10-3 |
||||||
Эффективная константа скорости
гетерогенного процесса k* в этом температурном
интервале, изменяется от 0,025 до 35,03.
Физико-химические основы протекания процесса
самоочистки
воды от формальдегида следующие.
При гетерогенном катализе возможны процессы, которые
описываются следующими схемами:
1 стадия – распад пероксида водорода.
3H2O2 → 1,5O2 + 3H2O (быстрая стадия);
2 стадия (лимитирующая) – окисление формальдегида до
муравьиной
кислоты кислородом, образовавшимся в результате разложения пероксида.
2HCOH + O2 → 2HCOOH (медленная).
3 стадия – окисление муравьиной кислоты кислородом,
образовавшимся в результате разложения пероксида с образованием промежуточного
соединения (гидроксо кислоты – CHOОOH).
Процесс протекает по следующей схеме:
HCOOH + 0,5O2 → 2CHOOOH (быстрая), или 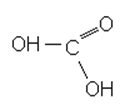
4 стадия – гидроксокислота, как нестойкое соединение образует углекислый газ и воду.
Процесс протекает по следующей схеме:
HCOOOH → CO2 +H2O (быстрая стадия).
Образования пероксида водорода в водоёме происходит при фотосинтезе (воздействие энергии солнечного света) с участием микроорганизмов. Данный процесс под воздействием внешней световой энергии можно представить следующей схемой:
Анодный
процесс ![]() (
(![]() ); процесс окисления;
); процесс окисления;
Катодный
процесс ![]() (
(![]() ); процесс восстановления;
); процесс восстановления;
___________________________
![]() – суммарное уравнение (уравнение
самоокисления-самовосстановления).
– суммарное уравнение (уравнение
самоокисления-самовосстановления).
Константа равновесия для данного процесса равна
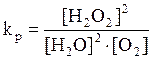 .
.
Если
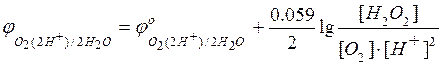 – потенциал
катодного процесса,
– потенциал
катодного процесса,
а 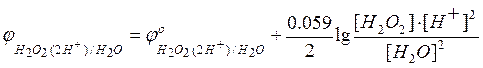 –
потенциал анодного процесса.
–
потенциал анодного процесса.
Тогда условие равновесия будет
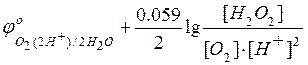 =
=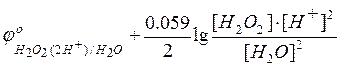
Преобразуя данное уравнение, как разницу между анодным и катодным процессами, возможно определить константу равновесия данного процесса:
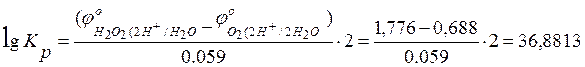 ,
,
![]() .
.
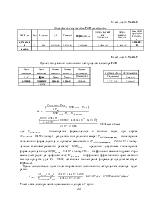
Табл. 1
Определение константы скорости образования пероксида водорода под воздействием энергии солнца
|
lgKp |
Анодный потенциал fанода |
Катодный потенциал fкатода |
Kp |
|
36,88135593 |
1,776 |
0,688 |
7,609E+36 |
Так как константа равновесия больше единицы, то процесс образования пероксида водорода вероятен: энергия Гиббса данного процесса равна :
Табл.2
Энергия Гиббса данного процесса равна
|
Энергияа |
Постоянная |
Частота светов. |
|||
|
Гиббса |
Планка |
излучения |
|||
|
∆G, Дж/мольК |
R, Дж/мольК |
Kp |
lnKp |
h |
n,Гц |
|
-1,8446E-16 |
-8,3140E+00 |
7,6095E+36 |
8,4922E+01 |
6,6260E-34 |
3,9430E+14 |
|
∆G<0 |
отрицательный знак ∆G указывает на возможность протекания процесса |
||||
![]()
где величина 2,612∙10-19 соответствует температуре, которая эквивалентна энергии светового излучения Q=E=n∙h=3,943∙1014∙6,626∙10-34=2,612∙10-19 Дж/моль∙с∙К,
где n – частота светового потока,
которая равна 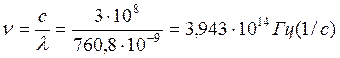 ; h=6,626∙10-34
Дж∙с – постоянная Планка. Тогда масса образовавшегося пероксида от квант энергии
будет равна
; h=6,626∙10-34
Дж∙с – постоянная Планка. Тогда масса образовавшегося пероксида от квант энергии
будет равна 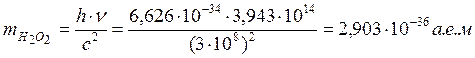 , что соответствует
1,66057∙10-27 кг∙2,903 а.е.м.= 4,8206∙10-63 кг= 4,8206∙10-60
г
, что соответствует
1,66057∙10-27 кг∙2,903 а.е.м.= 4,8206∙10-63 кг= 4,8206∙10-60
г
Результаты экспериментальных данных показали, что концентрация пероксида
водорода в воде составляет ![]() или
или ![]() .[1]*.
.[1]*.
При очистке сточных вод от примесей формальдегида (HCOH), который особенно опасен для микроорганизмов биологических очистных сооружений, применяется физико-химический метод очистки, основанный на окислении формальдегида пероксидом водорода, в присутствии катализаторов (Pt, Cd, С и т. д.), образующегося в процессе фотосинтеза, описанный выше (гетерогенно-каталитическая система). Гетерогенный катализ сложный физико-химический процесс, который протекает на границе раздела фаз, характеризующийся как диффузией вещества в зону взаимодействия, так и кинетикой (скоростью взаимодействием). Катализатор образует с одним из исходных, веществ промежуточные соединения, активируя данный реагент. В настоящее время нет единой теории, на основе которой можно выбрать для каждого процесса наиболее подходящий катализатор. Поэтому в работе поставлена задача подобрать наиболее подходящий электрод-катализатор с экологической и экономической оценкой его применения.
При
гетерогенном катализе возможны процессы, которые
описываются следующими схемами:
1 стадия – распад пероксида водорода.
Результат стехиометрического расчёта показал, что
3,4∙10-5 г. 1,6∙10-5 г
3H2O2 → 1,5O2 + 3H2O (быстрая стадия);
102 г/моль 48 г/моль 54 г/моль
в результате данного процесса
образовалось 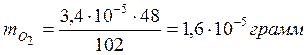 кислорода.
кислорода.
2
стадия (лимитирующая) – окисление формальдегида до муравьиной кислоты
кислородом,
образовавшимся в результате разложения пероксида.
Результат
стехиометрического расчёта показал, что на окисление формальдегида по приведенной
схеме, необходимо 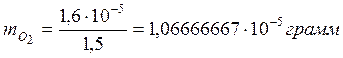 кислорода.
кислорода.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.