










Группа
Федорова Е.
Вариант 5
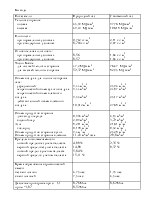
|
№ задания |
Месторождение газа |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
СО2 |
Н25 |
N2 |
|
5 |
Медвежье |
99 |
0,1 |
0,005 |
- |
- |
0,095 |
- |
0,8 |
1. Определяем теплоту сгорания газа
1.1 Низшая теплота сгорания
Qн=0,01× (∑Qнi × CmHn)=0,01× (35,88×99+64,36×0,1+93,18×0,005)=35,59 МДж/м3
1.2 Высшая теплота сгорания
Qв=0,01× (∑Qвi × CmHn)=0,01× (39,82×99+70,31×0,1+101,2×0,005)=39,49 МДж/м3
2. Определяем плотность газа
2.1 Плотность при нормальных условиях t=0°С и Рб=01 Мпа
ρ=0,01× (∑р i × ri)= 0,01× (0,72 СН4+1,35 С2Н6+2,01 С3Н8+1,97 СО2+2,01 N2)= =0,01(0,72×99+1,35×0,1+2,01×0,005+1,97×0,095+2,01×0,8)=0,732 кг/ м3
2.2 Плотность при t=20°С и Ризб=0,005 Мпа
![]() =
=![]()
3. Определяем относительную плотность газа
3.1 при нормальных условиях при t= 0°С и ρвозд =1,29
d= ρсм = 0,732 = 0,56
ρвозд 1,29
3.2 при стандартных условиях t= 20°С и ρвозд = 1,25
d= ρсм = 0,716 = 0,57
ρвозд 1,25
4. Определяем Число Воббе
4.1 для низшей теплоты сгорания
Wон= Qн см = 35,59 =47,2 МДж/м3
![]()
![]() ,57
,57
4.2 для высшей теплоты сгорания
Wон= Qв см = 39,49 = 52,37МДж/м3
![]()
![]() ,57
,57
5. Определяем объем воздуха, требующегося для полного сгорания газа
5.1 Усредненный
Vт= Qн = 35,59 =9,44 м3/м3
3,77 3,77
5.2 Теоретический объем сухого воздуха для горения, м3/м3 газа:
![]() (0,5H2 +
0,5CO + 2CH4 + 3,5C2H6 + 5C3H8
+ 6,5C4H10 + 3C2H4 + 4,5C3H6
+ 6C4H8 –
O2)=
(0,5H2 +
0,5CO + 2CH4 + 3,5C2H6 + 5C3H8
+ 6,5C4H10 + 3C2H4 + 4,5C3H6
+ 6C4H8 –
O2)=
=4,76 (2×99 + 3,5×0,1 + 5×0,005 )=9,44 м3/м3 газа
100
5.3 Теоретический объем влажного воздуха для горения больше теоретического объема сухого воздуха на величину объема содержащегося в воздухе водяного пара. Объем 1 кг водяных паров при нормальных условиях составляет 1,24 м3
Vв т.вл= Vв т.с +1,24dв Vв т.с =(1+1,24 dв) Vв т.с =(1+1,24×0,01) × 9,44=9,55 м3/м3
газа где dв – абсолютная влажность воздуха
принимаем по i—d-диаграмме влажного воздуха для t =
20 ![]() и
и ![]() = 60 %
определяем влагосодержание x = 8,8 г/кг сухого воздуха и плотность
воздуха
= 60 %
определяем влагосодержание x = 8,8 г/кг сухого воздуха и плотность
воздуха ![]() = 1,2 кг/м3. Отсюда можно
вычислить абсолютную влажность воздуха:
= 1,2 кг/м3. Отсюда можно
вычислить абсолютную влажность воздуха:
![]() г/м3
= 0,01 кг/м3
г/м3
= 0,01 кг/м3
5.4 Действительное количество влажного воздуха, доставляемого в зону горения
![]() =1,1×9,557=10,512
м3/м3 газа
=1,1×9,557=10,512
м3/м3 газа
где α – коэффициент избытка воздуха, принимаем α= 1,1
Также
коэффициент![]() можем определить, зная нижний предел
воспламеняемости газа с учетом балласта, по формуле:
можем определить, зная нижний предел
воспламеняемости газа с учетом балласта, по формуле:
aрасч=(100/![]() -1)×(1/ Vвт.вл)=(100/5,04 -1)×(1/9,55)=1,97
-1)×(1/ Vвт.вл)=(100/5,04 -1)×(1/9,55)=1,97
После чего определить действительный объем влажного воздуха при aрасч=1,97:
Vввл= aрасч× Vвт.вл=1,97×9,55=18,81 м3/м3
6.Определяем объемы продуктов сгорания (влажные)
Действительный объем продуктов сгорания углеводородных газов, м3/м3 газа, во влажном воздухе, подаваемом с необходимым избытком:
6.1 Диоксид углерода
![]()
![]() =0,01(0,095+1×99+2×0,1+3×,005)=0,993 м3/м3 газа
=0,01(0,095+1×99+2×0,1+3×,005)=0,993 м3/м3 газа
6.2 Водяной пар
![]()
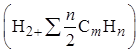 + 1,24
+ 1,24![]() =0,01(2 ×99 +3×0,1т 4×0,005) + 1,24(0,01 + +1,1×0,01×9,44)
= 2,09 м3/м3 газа при α= 1,1 где dг — абсолютная
влажность газа, кг/м3. dг=10 гр., где dв —влажность воздуха, кг/м3.
dв=10 гр.,
=0,01(2 ×99 +3×0,1т 4×0,005) + 1,24(0,01 + +1,1×0,01×9,44)
= 2,09 м3/м3 газа при α= 1,1 где dг — абсолютная
влажность газа, кг/м3. dг=10 гр., где dв —влажность воздуха, кг/м3.
dв=10 гр.,
![]() =0,01(2 ×99+3×0,1+4×0,005)+1,24(0,01+1,97×0,01×9,44)=2,09 =2,22
м3/м3 при α=1,97
=0,01(2 ×99+3×0,1+4×0,005)+1,24(0,01+1,97×0,01×9,44)=2,09 =2,22
м3/м3 при α=1,97
6.3 Азот
![]() N2 + 0,79
N2 + 0,79![]() =0,01
× 0,8 + 0,79 × 1,1 ×
9,44 = 8,211 м3/м3 газа при
α= 1,1
=0,01
× 0,8 + 0,79 × 1,1 ×
9,44 = 8,211 м3/м3 газа при
α= 1,1
![]() N2 + 0,79
N2 + 0,79![]() =0,01
× 0,8 + 0,79 × 1,97
× 9,44 = 14,69 м3/м3 газа при
α=1,97
=0,01
× 0,8 + 0,79 × 1,97
× 9,44 = 14,69 м3/м3 газа при
α=1,97
6.4 Кислород
![]() O2 + 0,21
O2 + 0,21![]() =0,21×(1,1 - 1) × 9,44 = 0,198 м3/м3
газа при α= 1,1
=0,21×(1,1 - 1) × 9,44 = 0,198 м3/м3
газа при α= 1,1
![]() O2 + 0,21
O2 + 0,21![]() =0,21×(1,97 - 1) × 9,44 = 1,92 м3/м3
газа при α=1,97
=0,21×(1,97 - 1) × 9,44 = 1,92 м3/м3
газа при α=1,97
6.5 Суммарный объем сухих продуктов сгорания ![]() ,
,
![]() =
=
![]() +
+ ![]() +
+ ![]() =0,933 + 8,211 + 0,198=9,4 м3/м3
газа при α= 1,1
=0,933 + 8,211 + 0,198=9,4 м3/м3
газа при α= 1,1
![]() =
=
![]() +
+ ![]() +
+ ![]() =0,933 + 14,69 + 1,92=17,54 м3/м3
газа при α=1,97
=0,933 + 14,69 + 1,92=17,54 м3/м3
газа при α=1,97
6.6 Суммарный объем влажных продуктов сгорания ![]() :
:
![]() =
= ![]() +
+ ![]() +
+ ![]() +
+ ![]() =0,933
+ 2,09 + 8,211 +0,198 = 11,43 м3/м3 газа α= 1,1
=0,933
+ 2,09 + 8,211 +0,198 = 11,43 м3/м3 газа α= 1,1
![]() =
= ![]() +
+ ![]() +
+ ![]() +
+ ![]() =0,933
+ 2,22 + 14,69 +1,92 = 19,76 м3/м3 газа α= 1,97
=0,933
+ 2,22 + 14,69 +1,92 = 19,76 м3/м3 газа α= 1,97
7. Определяем пределы воспламеняемости
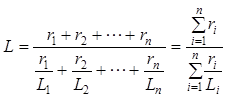
состав газа:
СН4= 99 ×100=99,895 %
99,105
С2Н6=0,1 ×100=0,1009 %
99,105
С3Н8=0,005 ×100=0,00504 %
99,105
7.1 Нижний предел воспламеняемости без учета балласта
100
L н=99,895 + 0,1009 +0,00504 = 4,99 %
5 3,2 2,4
7.2 Верхний предел воспламеняемости без учета балласта
100
L в=99,895 + 0,1009 +0,00504 = 14,99 %
15 12,5 9,5
7.3 Определяем пределы воспламеняемости с учетом балласта б =0,895/100 =0,00895 количество балласта в долях
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.