(1+ б ) .100 (1 + 0,00895 ) .100
Lбн = Lн × 1-б =4,99× 1-0,00895 = 5,04 %
____________ ________________
100+ Lн . б 100 +4,99 . 0,00895
1-б 1-0,00895
(1+ б ) .100 (1 + 0,00895 ) .100
Lбв= L в × 1-б =14,99. 1-0,00895 = 15,11 %
____________ ________________
100+ L в б 100 +14,99 . 0,00895
1-б 1-0,00895
8.Определяем время образования взрывоопасной смеси при утечке газа
Определяем количество газа для помещения для образования нижнего предела взрываемости
Vзаг= Vпом× L н=15×0,0504=0,75 м3
Принимая количество газа, поступающего с помещение через 1 комфорку газовой плиты Vу=0,2 м3/час,
Время образования опасной смеси
τ= Vзаг/ Vу= 0,75 /0,2= 3,75 час
Определяем время образования опасной смеси с учетом вентиляции:
τʹ= τ×А= 3,75 ×2=7,5 час где кратность воздухообмена А=2
9. Максимально возможное давление при взрыве газа:
Рвзр=Ро ×
(1+![]() tк) Vвлп.с. = 0,1(1+ 1 ×1880 ) 11,43
=0,78 МПа
tк) Vвлп.с. = 0,1(1+ 1 ×1880 ) 11,43
=0,78 МПа
1+αVвл т 273
1+1,1×9,55 где Ро— давление в сосуде перед взрывом, МПа
=0,1 МПа, ![]() -
коэффициент объемного расширения газов,
-
коэффициент объемного расширения газов, ![]() =1/273; α =1,1; tк=1880 °С принимается из таблицы 2 «Калориметрическая
и теоретическая температуры горения природного газа в воздухе с температурой 0 °C и влажностью 1 % мас.* в
зависмости от коэффициента избытка
воздуха α»
=1/273; α =1,1; tк=1880 °С принимается из таблицы 2 «Калориметрическая
и теоретическая температуры горения природного газа в воздухе с температурой 0 °C и влажностью 1 % мас.* в
зависмости от коэффициента избытка
воздуха α»
Рвзр=Ро ×
(1+![]() tк)Vвлп.с. =0,1(1+ 1 ×1185 ) 19,76
=0,52 МПа
tк)Vвлп.с. =0,1(1+ 1 ×1185 ) 19,76
=0,52 МПа
1+αVвл т 273 1+1,97×9,55 где α =1,97 tк=1185 °С
Вариант 5
Состав сжиженных углеводородных газов
|
№ задания |
Марка сжиженного газа |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
|
5 |
ПТ – пропан технический |
4 |
78 |
17 |
1 |
1. Определяем теплоту сгорания газа
1.1 Низшая теплота сгорания
Qн=0,01× (∑Qнi × CmHn)=0,01× (64,36×4+93,18×78+123,6×17+156,6×1)=97,76 МДж/м3
1.2 Высшая теплота сгорания
Qв=0,01× (∑Qвi × CmHn)=0,01× (70,31×4+101,2×78+133,8×17+169,3×1)=106,18 МДж/м3
2. Определяем плотность при нормальных условиях
ρ=0,01× (∑р i × ri)= 0,01× (1,35 С2Н6+2,01 С3Н8+2,708 С4Н10+3,22 С5Н12)= 0,01(1,35 ×4+2,01 ×78+2,708 ×17+3,22 ×1)=2,11 кг/ м3
ρ20°= ρ0° × 273(Рб+Ризб) =2,11 × 273× (0,1+0,005)=2,07 кг/ м3,
(273+ t)×0,1 (273+20) ×0,1
принимая Ризб=0,005 Мпа
d= ρсм = 2,11 = 1,63 , где ρвозд =1,29 при t= 0°С
ρвозд 1,29
d= ρсм = 2,07 = 1,65 где ρвозд = 1,25 при t= 20°С
ρвозд 1,25
W= Qн см = 97,76 = 76,37 МДж/м3
![]()
![]()
W= Qв см = 106,18 = 82,95 МДж/м3
![]()
![]()
6. Определяем объем воздуха, требующегося для полного сгорания газа
6.1 Усредненный:
Vт= Qн/3,77= 97,76/3,77 =25,93 м3/м3
6.2 Теоретический объем сухого воздуха для горения, м3/м3 газа:
![]() (3,5×4 + 5×78 + 6,5×17 + 8×1)=24,87 м3/м3 газа
(3,5×4 + 5×78 + 6,5×17 + 8×1)=24,87 м3/м3 газа
6.3 Теоретический объем влажного воздуха для горения больше теоретического объема сухого воздуха на величину объема содержащегося в воздухе водяного пара. Объем 1 кг водяных паров при нормальных условиях составляет 1,24 м3
Vв т.вл= Vв т.с +1,24dв Vв т.с =(1+1,24 dв) Vв т.с =(1+1,24×0,01) × 24,87=25,17 м3/м3
газа где dв – абсолютная влажность воздуха
принимаем по i—d-диаграмме влажного воздуха для t =
20 ![]() и
и ![]() = 60 %
определяем влагосодержание x = 8,8 г/кг сухого воздуха и плотность
воздуха
= 60 %
определяем влагосодержание x = 8,8 г/кг сухого воздуха и плотность
воздуха ![]() = 1,2 кг/м3. Отсюда можно
вычислить абсолютную влажность воздуха:
= 1,2 кг/м3. Отсюда можно
вычислить абсолютную влажность воздуха:
![]() г/м3
= 0,01 кг/м3
г/м3
= 0,01 кг/м3
Действительное количество влажного воздуха, доставляемого в зону горения
![]() =1,1×25,17=27,68
м3/м3 газа
=1,1×25,17=27,68
м3/м3 газа
где α – коэффициент избытка воздуха, принимаем α= 1,1
7.Определяем объемы продуктов сгорания (влажные)
7.1 Диоксид углерода
![]()
![]() =0,01(2×4+3×78+4×17+5×1)=3,15
м3/м3 газа
=0,01(2×4+3×78+4×17+5×1)=3,15
м3/м3 газа
Также
коэффициент![]() можем определить самостоятельно зная
нижний предел воспламеняемости газа,
по формуле:
можем определить самостоятельно зная
нижний предел воспламеняемости газа,
по формуле:
aрасч=(100/Lн-1)×(1/ Vвт.вл)=(100/2,35 -1)×(1/25,17)=1,65
7.2 Водяной пар
![]()
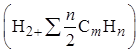 + 1,24
+ 1,24![]() =
0,01(3×4+3×78+5×17+6×1)
+1,24(0,01+1,1×0,01×24,87) = 3,72 м3/м3 газа при α= 1,1
=
0,01(3×4+3×78+5×17+6×1)
+1,24(0,01+1,1×0,01×24,87) = 3,72 м3/м3 газа при α= 1,1
где dг — абсолютная влажность газа, кг/м3. dг=10 гр., dв —влажность воздуха, кг/м3, dв=10 гр., α= 1,1
![]()
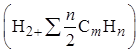 +1,24
+1,24![]() =0,01(3×4+3×78+5×17+6×1)+1,24(0,01+1,65×0,01×24,87)
=3,89 при α= 1,65
=0,01(3×4+3×78+5×17+6×1)+1,24(0,01+1,65×0,01×24,87)
=3,89 при α= 1,65
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.