Коэффициент распределения находится экспериментально и отражается в справочной литературе. Для определения (оценки) поведения веществ в окружающей среде обычно используют значение коэффициента распределения для систем вода/углеводород (гексан, циклогексан, октан) либо вода/н-октанол.
4. рК – показатель константы кислотности или основности
Многочисленную группу химических веществ, попадающих в окружающую среду составляют органические кислоты и основания, которые относятся к слабым кислотам или основаниям и могут находиться в среде в молекулярной или ионизированной форме. Для оценки поведения и возможностей распространения вещества в окружающей среде необходимо оценивать преобладающую форму данного вещества, которая связана со степенью диссоциации молекул.
Количество диссоциированных молекул (степень диссоциации) является рК конкретного соединения и рН среды, в которой они находятся. Проанализируем эту зависимость.
Слабая кислота диссоциирует по реакции:
![]()
 |
|||
 |
|||
Для сопряженного основания
равновесие: ![]()
Константа равновесия (кислотности) Ка определяется как:
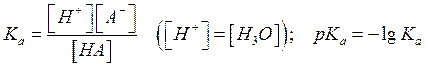
рН и рКа связаны
уравнением 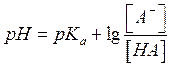 - уравнение Гендерсона-Хассельбаха
(это уравнение используется для расчета составляющих буферных расворов, в
которых рН – зависимая переменная, а [A-] и [HA] можно регулировать)
- уравнение Гендерсона-Хассельбаха
(это уравнение используется для расчета составляющих буферных расворов, в
которых рН – зависимая переменная, а [A-] и [HA] можно регулировать)
при рассмотрении ситуации, связанной с загрязнением окружающей среды необходимо знать [A-] и [HA] (состояние диссоциированной и недиссоциированной форм)
Эти концентрации можно выразить в
виде функции рН и рК: 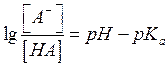
Если общая концентрация вещества (А)
равна ![]() , то (подставив в уравнение Ка получим):
, то (подставив в уравнение Ка получим):
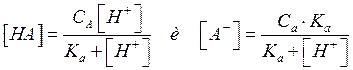
Измененяя концентрации [HA] и [A-] при изменении рН среды при некоторой определенной концентрации СА вещество с известным значением рКа выглядит следующим образом:
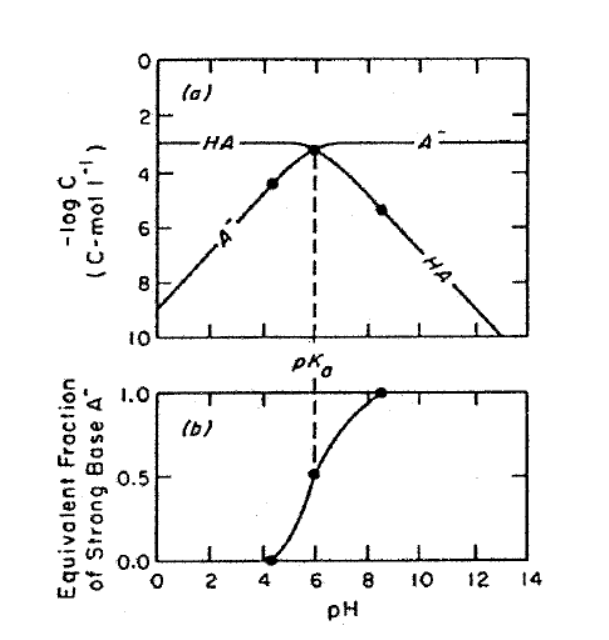
|
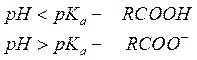
Аналогично можно показать зависимость преимущественной формы присутствия в окружающей среде оснований. В общем случае диссоциация основания идет по уравнению:
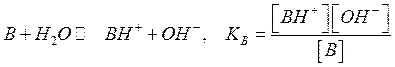
Часто задается константа кислотности для кислоты, сопряженной с данным основанием для равновесия:
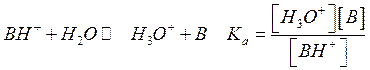
В этом случае Ка и Кв
связаны между собой ![]() (константа для
воды Kw=10-14) или
(константа для
воды Kw=10-14) или ![]()
|
![]()
Переход одной формы в другую в основном происходит в диапазоне изменения pH ~ на 3 единицы от значения pH=pK (в обе стороны)
Миграционные процессы химических веществ в окружающей среде
Основные процессы определяющие перемещение веществ в окружающей среде:
1) Адсорбция
2) Диффузия
3) Конвективный перенос
4) Массоперенос (выщелачивание)
5) Испарение
Адсорбция – связывание молекул или атомов жидкой или газовой фаз на твердой поверхности
В окружающей среде наибольшее значение имеют адсорбционные процессы на твердой поверхности из раствора. Именно они в значительной (мере):
1. Влияют на способность веществ перемещаться в ОС (например, с частицами почвы)
2. Определяют распределение веществ между водной средой и почвой или донными отложениями
3. Определяют возможность удаления химических веществ с помощью различных адсорбентов
Адсорбционные процессы в ОС многообразны и протекают как по механизму физической адсорбции, обусловленными силами Ван-дер-ваальсового взаимодействия, так и хемосорбции – адсорбции, сопровождающейся образованием химических связей.
На интенсивность адсорбционного процесса влияет ряд факторов:
· Свойства сорбента: 1-площадь поверхности, 2-химические характеристики (природа адсорбционных центров – наличие заряда, способность образовывать водородные связи, наличие гидрофобных центров и т.п.)
· Химические характеристики сорбируемого вещества (адсорбата);
· Физические параметры среды (напр., температура)
В адсорбционном процессе, протекающем в ОС, устанавливается следующее равновесие:
Поверхность (Н2О)х+адсорбат(Н2О)у↔поверхность-адсорбат(Н2О)z
(к каждому члену уравнения следует добавить Н2О, поскольку в ОС, как правило, имеем дело с адсорбцией их водного раствора, причем вода так же сорбируется на поверхности)
Адсорбция в ОС (на поверхности почвы) часто обратима не полностью. Недосорбирующаяся часть включается прочно связанными с поверхностью почвы молекулами, например, в результате образования ковалентных связей с органическими компонентами почвы, либо в результате необратимого встраивания молекул адсорбата в структуру минеральной части почвы.
Адсорбционное равновесие зависит от
температуры и может быть описано уравнение вида: ![]() -
уравнение изотермы адсорбции Фрейндлиха – отражает зависимость количества вещества
адсорбированного единицей массы адсорбента от равновесной концентрации данного
вещества в растворе при данной температуре.
-
уравнение изотермы адсорбции Фрейндлиха – отражает зависимость количества вещества
адсорбированного единицей массы адсорбента от равновесной концентрации данного
вещества в растворе при данной температуре.
В уравнении: Х – количество адсорбированного вещества
m – масса адсорбента
С – равновесная концентрация вещества в растворе
К – константа равновесия, т.е. коэффициент распределения вещества между двумя фазами в равновесном состоянии или коэффициент адсорбции – характеризует прочность адсорбции. Зависимость, выраженная уравнением Френдлиха находится экспериментально для каждоый системы адсорбент-адсорбат
В идеальном случае изотерма
адсорбции линейна, т.е. уравнение Френдлиха имеет вид ![]() и
графически выглядит
и
графически выглядит
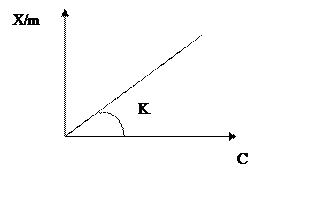 |
В реальных случаях изотерма нелинейна. Показатель степени в уравнении Фрейндлиха характеризует нелинейность изотермы и отражает, то что по мере заполнения поверхности адсорбента теплота адсорбции падает в следствие неоднородности в энергетическом отношении поверхности адсорбента
Чисто
графически уравнение Фрейндлиха представляю в логарифмических координатах, т.е.
логарифмируя уравнение получаем ![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.