1) детяльеностью всех возможных источников примесей
2) процессами удаления за счет химических реакций и осаждения
3) турбулентным переносом (диффузией)
С учетом этого для описания изменения концентрации вещества во времени в любой точке атмосферы ________ модель следующего вида:
![]()
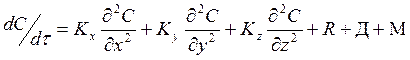 , где
, где
|
С – концентрация компонента в данной точке пространства,
Кх, Ку, Кz – горизонтальные и вертикальные составляющие коэффициента турбулентной диффузии
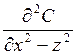 -
производная изменения концентрации по направления – скорость уноса приходит по
направлению, т.е. скорость турбулентной диффузии по направлению
-
производная изменения концентрации по направления – скорость уноса приходит по
направлению, т.е. скорость турбулентной диффузии по направлению
R – общая скорость изменения концентрации за счет химических процессов
Д – то же за счет физических процессов (сухого и влажного оседания)
М – общая скорость изменения концентрации за счет поступления вещества в атмосферу от всех источников.
Применение данного уравнения к реальным процессам весьма затруднительно из-за значительных неопределенностей турбулентного движения примесей и соответственно неопределенности численных значений К и скорости турбулентной диффузии.
Тем не менее при определенных упрощениях данная модель используется для получения аналитических зависимостей изменения концентрации химических веществ в атмосфере, которые лежат в основе расчетов при оценке уровня загрязнения атмосферы химическими веществами.
Химические процессы в верхних слоях атмосферы
Верхние слои атмосферы в значительной мере определяют условия жизни на Земле, поскольку играют роль защитного барьера на пути излучения высокой энергии (чувствительной для живых организмов).
Один из важнейших процессов, протекающих в верхних слоях – диссоциации кислорода с образованием атомарного кислорода, который играет очень большую (основную) роль в химических превращениях в верхних слоях атмосферы. Энергия необходимая для диссоциации = 502 кДж/моль и соответствует верхней границе диапазона излучения 240 нм.
![]()
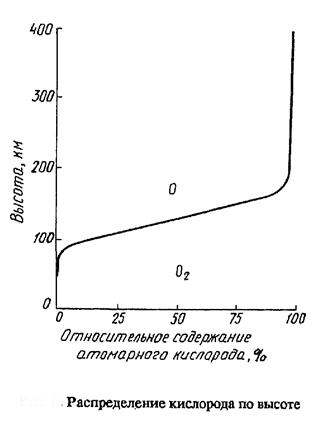 Вследствие этого с
высоты ~ 100 км кислород находится как в
молекулярной так и атомарной формах. Относительно содержания атомарного
кислорода иллюстрирует график – на высоте ~ 130 км содержание атомарной и молекулярной форм примерно
одинаково.
Вследствие этого с
высоты ~ 100 км кислород находится как в
молекулярной так и атомарной формах. Относительно содержания атомарного
кислорода иллюстрирует график – на высоте ~ 130 км содержание атомарной и молекулярной форм примерно
одинаково.
На высоте 80-90 км и выше (в мезо и термосферы)коротковолновые УФ излучения вызывают ионизацию основных компонентов – N2, O2, O, поглощая наиболее коротковолновые излучения ионизирубются:
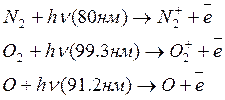
Образующиеся ионы могут участвовать в реакциях нескольких типов:
- диссоциативной рекомбинации (захват электроном молекулярных ионов и распад на атомы):
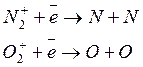
- в реакциях с переносом заряда (взаимодействие с другой молекулой)
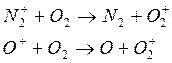 либо
возможны реакции:
либо
возможны реакции: 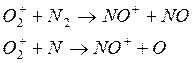
Следствием наличия в верхних слоях атомарных N и О является образование NO, который также участвует в реакциях рассмотренных типов:
1) способен поглощать радиацию:
![]()
2) ион NO+ также может диссоциативно рекомбинировать:
![]()
3) способен участвовать в реакциях с переносом заряда (принимать заряд)
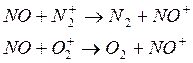
Ион NO+ распадается лишь в результате диссоциативной рекомбинации. В реакциях другого типа он вследствие низкой активности не участвует и поэтому является основные ионным компонентом верхней части термосферы (ионосферы).
На более низких высотах (30-50 км - тратосфера) коротковолновое излучение еще достаточно интенсивно (хотя основная его часть поглощена выше) и также способно вызвать диссоциацию О2 (по реакции (1)):
![]()
[правило Хунда (Гунда) – в свободной квантовой ячейке электроны располагаются так, чтобы их суммарный спин был максимальный (отталкивание между неспаренными электронами меньше чем между спаренными, поэтому триплетный более энергетически выгоден чем синглетный)]
В зависимости от величины энергии поглощенного кванта один или оба образующихся атом кислорода могут находится в возбужденном состоянии O (1Д). Метастабильный O (1Д) очень активная частица с временем жизни в стратосфере около 110 сек. Его дезактивация (тушение) происходит в результате столкновения и химической реакции с молекулами О2 или других газов (очевидно, преимущественно азота), а так же с молекулой Н2О. Эти реакции протекают с высокой скоростью, в каждом случае образуется атомарный О в основном состоянии:
С О2 а) ![]()
Наряду с О (3р)
продуктом реакции является синглетный метастабильный молекулярный кислород в
низшем (из возможных) электронно возбужденном состоянии [энергия которого
превышает энергию основного состояния лишь на 94 Дж]. Синглетный ![]() не отличается высокой реакционной
способностью. Для него характерен излучательный переход в основное состояние
не отличается высокой реакционной
способностью. Для него характерен излучательный переход в основное состояние ![]() и время жизни достаточно велико [он
образуется еще несколькими путями – о чем чуть позже]
и время жизни достаточно велико [он
образуется еще несколькими путями – о чем чуть позже]
C другими молекулами б) ![]()
(перенос избыточной энергии к другой молекуле)
Образуется возбужденная
частица (например, молекула ![]() ), для которой
характерно тепловое (или излучательное) рассеяние энергии возбуждения
), для которой
характерно тепловое (или излучательное) рассеяние энергии возбуждения
С Н2О в) ![]() К=2,9*10-11
К=2,9*10-11
Параллельно может идти также реакция с образование гидроксильных радикалов
![]() К=2,2*10-10 см/моль
К=2,2*10-10 см/моль
Очень важная в химии атмосферы
Атомарный кислород в основном состоянии О(3р) выполняет очень важную роль, так как участвует в образовании озона как в стратосфере, так и в тропосфере.
В принципе озон – высокотоксичный газ, его токсичность примерно на порядок выше, чем у SO2. Он к тому же сильнейший окислитель, поэтому в воздухе тропосферы озон представляет высокую опасность для всего живого. Но в стратосфере озон, как отмечалось, выполняет очень важную функцию и снижение его концентрации на этой высоте несет серьезную опасность.
Для характеристики содержания озона в атмосфере используют специальную систему измерения – единицу Добсона (е.Д.). Название это получено от названия спектрометра Добсона, который первоначально применяли для измерения концентрации озона. Спектрометр позволял достаточно точно определить общее содержание озона в столбе воздуха над наблюдателем (над прибором).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.