В классической статистической физике выводится закон Больцмана о равномерном
распределении по степеням свободы молекул: для статистической
системы, находящейся в состоянии термодинамического равновесия, на каждую
поступательную и вращательную степень свободы приходится в среднем кинетическая
энергия, равная одной второй ![]() , а на каждую
колебательную – в среднем энергия, равная kT.
, а на каждую
колебательную – в среднем энергия, равная kT.
Для потенциальной энергии различных степеней свободы такого общего закона не существует
Следовательно, средняя кинетическая энергия молекул идеального газа, находящегося в равновесном состоянии:

![]() (8)
(8)

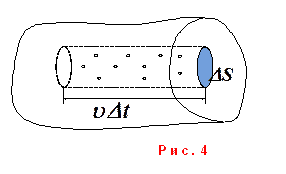 ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ. УРАВНЕНИЕ
КЛАПЕЙРОНА – МЕНДЕЛЕЕВА. ЗАКОН АВОГАДРО. ЗАКОН ДАЛЬТОНА.
ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ. УРАВНЕНИЕ
КЛАПЕЙРОНА – МЕНДЕЛЕЕВА. ЗАКОН АВОГАДРО. ЗАКОН ДАЛЬТОНА.
Рассмотрим идеальный одноатомный газ. Выделим (рис. 4) в стенке сосуда элементарную площадку ΔS.
Для каждой молекулы, движущейся к выделенной площадке, изменение проекции импульса молекулы по направлению 0х:
![]()
![]() (9).
(9).
![]()
За Δt к стенке подлетят молекулы, находящиеся
в цилиндре объемом ![]() (10).
(10).
Для упрощения расчетов:
1) хаотическое движение заменяют на движение вдоль трех взаимно перпендикулярных направлений;
2) вдоль каждой оси в
любой момент времени движется ![]() молекул одну сторону, и
молекул одну сторону, и
![]() - в противоположную.
- в противоположную.
![]() При столкновении с площадкой молекулы
передают ей импульс:
При столкновении с площадкой молекулы
передают ей импульс: ![]() (11)
(11)
 Давление газа, оказываемое им на стенку
сосуда:
Давление газа, оказываемое им на стенку
сосуда:
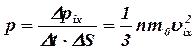 (12)
(12)
Если газ в объеме V содержит N молекул, движущихся со скоростями υ1, υ2 …υN, то следует рассматривать среднюю квадратичную скорость:

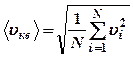 (13),
(12) с учетом (13):
(13),
(12) с учетом (13):

![]()
![]() (14) - основное уравнение молекулярно-кинетической
теории газов.
(14) - основное уравнение молекулярно-кинетической
теории газов.
![]()
![]()
![]()
![]() Т.
к.
Т.
к. 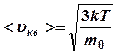
![]() (15),
(15), ![]() (15`)
(15`)
![]() Если в
сосуде находится смесь различных идеальных газов, количество которых j,
не вступающих в химические реакции друг с другом, то общая концентрация равна
сумме концентраций отдельных газов
Если в
сосуде находится смесь различных идеальных газов, количество которых j,
не вступающих в химические реакции друг с другом, то общая концентрация равна
сумме концентраций отдельных газов ![]() .
.

Закон Дальтона: давление смеси газов, не вступающих
в химические реакции друг с другом, равно сумма парциальных давлений ![]() .
.

Парциальным называется давление, которое создавал бы газ в данном сосуде, если бы он занимал его один.
Состояние некоторой массы газа определяется параметрами p, T,V.
![]() (16).
(16).
![]()
![]() (17) – уравнение Клапейрона.
(17) – уравнение Клапейрона.
![]()
![]() (18) – уравнение Клапейрона-Менделеева.
(18) – уравнение Клапейрона-Менделеева.
 |
ТЕМПЕРАТУРА. ЭМПИРИЧЕСКАЯ ШКАЛА ТЕМПЕРАТУР. АБСОЛЮТНАЯ ТЕРМОДИНАМИЧЕСКАЯ ШКАЛА.

Температурой называется скалярная физическая величина, характеризующая:
1) степень нагретости тела (вещества),
2) среднюю кинетическую энергию хаотического движения молекул в равновесном состоянии (состоянии термодинамического равновесия).

Нулевое начало термодинамики: если две системы находятся в термодинамическом равновесии с третьей системой, то они в термодинамическом равновесии друг с другом.
Третья система (пробное тело), посредством которой сравниваются состояния двух систем, должна быть такой, чтобы при контакте она существенно не изменяла равновесное состояние исследуемой системы.

Термометром называется проградуированное «пробное тело», которое используется для сравнения термодинамических состояний.

1)  термометрическое тело (вещество),
макроскопический параметр которого существенно зависит от степени нагретости;
термометрическое тело (вещество),
макроскопический параметр которого существенно зависит от степени нагретости;

 В термометре
используются:
В термометре
используются:
2) ![]() термометрическая величина (давление,
объем, длина, сопротивление и т.д.);
термометрическая величина (давление,
объем, длина, сопротивление и т.д.);

3) шкала с реперными точками, которым присвоено какое- либо значение температуры (например, точки кипения и замерзания воды при нормальном атмосферном давлении).
Реперные точки эмпирических температурных шкал:
![]()
Цельсия t1=00C, t2=1000C
Реомюра t1=00C, t2=800C
Фаренгейта t1=320C, t2=2120C
Абсолютная термодинамическая шкала или шкала Кельвина:
Термометрическое тело – идеальный газ, термометрическая величина – давление, реперные точки Т1 , Т2 – соответственно, точка замерзания воды и кипения воды при нормальном атмосферном давлении.
![]()
![]()
![]() Из Т2-Т1=100
и
Из Т2-Т1=100
и 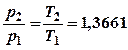 следует Т1=273,15К , Т2=373,15К
.
следует Т1=273,15К , Т2=373,15К
.

газовый термометр
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.