Исследование с помощью масс-спектрометра ИПДО-1 состава продуктов (рис.3) в области свыше 2 m/e показало, что основными продуктами реакции термического разложения являются СО2, СО и Н2О. Разложение идет в две стадии, что согласуется с данными термического анализа.
*Рис. 3 ( Рисунок есть отсканированный и его можно вставить)
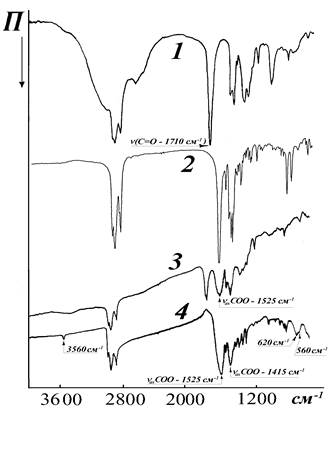 Из сравнения ИК-спектров поглощения
оксогидроксокаприлата висмута со спектром каприловой кислоты (рис.4 - кривые
1 и 4) следует, что изменения полос в их спектрах связаны с замещением водорода
карбоксильной группы на катион Вi6О4(ОН)46+.
Действительно, в спектрах солей отсутствуют полосы, принадлежащие колебаниям
карбоксильной группы: nOH - 3400-2500 см-1, dOH - 940 см-1 и nC=O - 1710 см-1,
а имеются полосы, соответствую-щие колебаниям карбоксилат-иона: nasCOO- 1525, плечо 1540 см -1 и ns COO- +dСH21415
см-1 [10]. Изменяется также соотношение интенсивностей максимумов
полосы деформационных dСН3
-колебаний, область 1500-1450 см-1. Кроме того, резко уменьшается
интенсивность полосы с максимумом 1300 см -1 - составные колебания: dОН + nC-O димера карбоновой кислоты.
Из сравнения ИК-спектров поглощения
оксогидроксокаприлата висмута со спектром каприловой кислоты (рис.4 - кривые
1 и 4) следует, что изменения полос в их спектрах связаны с замещением водорода
карбоксильной группы на катион Вi6О4(ОН)46+.
Действительно, в спектрах солей отсутствуют полосы, принадлежащие колебаниям
карбоксильной группы: nOH - 3400-2500 см-1, dOH - 940 см-1 и nC=O - 1710 см-1,
а имеются полосы, соответствую-щие колебаниям карбоксилат-иона: nasCOO- 1525, плечо 1540 см -1 и ns COO- +dСH21415
см-1 [10]. Изменяется также соотношение интенсивностей максимумов
полосы деформационных dСН3
-колебаний, область 1500-1450 см-1. Кроме того, резко уменьшается
интенсивность полосы с максимумом 1300 см -1 - составные колебания: dОН + nC-O димера карбоновой кислоты.
Рис. 4. ИК- спектры каприловой кислоты (1), каприлата натрия (2), сольватированного оксогидроксокаприлата висмута (3) и оксогидроксокаприлата висмута (4).
Наличие серии полос в области 1350-1150 см -1, принадлежащих веерным СН3 колебаниям и характеризующих длину углеводородной цепи, свидетельствует о транс-расположении этих групп.
Слабые полосы с максимумами 560 и 620 см -1, а также в области 1200-1050см -1, принадлежат, по-видимому, колебаниям катиона Вi6О4(ОН)46+. О наличии ОН-групп в данных соединениях свидетельствует также появление полосы поглощения при 3560 см -1, которая может быть отнесена к валентным колебаниям n(OH)-.
Сравнение продуктов осаждения висмута из перхлоратных растворов каприловой кислотой при различных молярных соотношениях с оксогидроксокаприлатом висмута, показало, что основные изменения в результатах их рентгенофазового, ИК-спектроскопического и термического анализов связаны с явлением сольватации оксогидроксокаприлата висмута избытком карбоновой кислоты. Попытки осаждения средней соли каприлата висмута по известным из литературных данных методикам [4] не увенчались успехом.
Синтез оксогидроксокаприлата висмута из хлорнокислых растворов
С целью получения оксогидроксокаприлата висмута высокой чистоты исследована возможность его синтеза из технического оксида с содержанием (мас.%): висмута – 88.35, свинца – 0.77, цинка – 6.4.10-4, сурьмы1.0.10-3, меди – 9.5.10-3, серебра – 5.6.10-2, мышьяка – 1.3.10-4, теллура – 8.2.10-5. Технический оксид растворяли в хлорной кислоте квалификации “ч” с концентрацией 8.7 моль/л. Полученный раствор содержал 1000 г/л висмута и 0.4 моль/л HСlO4.
Синтез оксогидроксокаприлата висмута (111) осуществляли добавлением хлорнокислого раствора висмута к раствору соответствующего каприлата натрия или аммония, полученному в результате нейтрализации монокарбоновой кислоты раствором гидроксида натрия или аммония при молярном соотношении карбоновой кислоты к висмуту равном 1.05, температуре 25 0С (синтез каприлата висмута) и рН равном 1.0. Осадок однократно промывали раствором хлорной кислоты с рН равным 1, водно-спиртовым раствором (1:1) и двукратно дистиллированной водой при температуре 60 °С, сушили при 100 °С. Полученный оксогидроксокаприлат содержал (мас. %): висмута -56.4, свинца- 1. 1О-5, цинка-1. 1О-5, железа- 8 .10-6, сурьмы-4 . 1О-6, меди-5. 1О-7, серебра-5.10-7, мышьяка - <,1. 1О-5 теллура - <.1. 1О-5, стеарат: висмута -42.04, свинца - 1. 1О-5, цинка -1. 1О-5, железа - 8 .10-6, сурьмы -4 .1О-6, меди -5.1О-7, серебра -5.10-7, мышьяка - <1. 1О-5 , теллура - <1. 1О-5.
Список литературы
1. Л.М. Гиндин, А.А. Васильева, И.М. Иванов Журн. неорган, химии, 10(1965)497
2. Ф.И. Лобанов, С.С. Досмагамбетова, В.А. Леонов, Журн. неорган, химии, 28(1983)2900
3. Т.А. Удалова, Ю.М. Юхин, Журн. неорган, химии, 40(1995)2072.
4. АЛ. Писаревский, Л.И. Мартыненко, Координац. химия, 20(1994)324
5. Е.А. Никитина, С.Н. Максимова, Журн. общей химии, 19(1949)1108.
6. А.И. Холькин, Т.Н. Адрианова, Н.В. Задонская, B.C. Еремеев, С.В. Вихрева, гН.В. Рябинин, В.А. Козлов, Докл. АН СССР, 312(1990)663.
7. B.Sundwall, Acta Chem. Seand., A34, N 3 (1980) 93.
8. Ю.М. Юхин, Т.А. Удалова, И.А. Ворсина, Журн. неорган, химии, 41(1996)690
9. T. Takahashi, Т. Kimura, К. Sakurai, Polymer, 40 (1999) 5939.
10.G. Gattow, D. Schutze, Z. anorg. allgem.chem., 328, H 1-2 (1964) 44.
11.Л. Беллами, Инфракрасные спектры сложных молекул, ИЛ, Москва, 1962.
12.G. Socrates, Infrared Characteristic Group Frequeneis, N.Y, 1980.
Вопросы: 1. Почему Bi6O4(OH)4R6 ди-2-этилгексилфосфат хорошо растворим в органических растворителях, а каприлат практически не растворим?
Возможность объяснения – у Д2ЭГФК в строении органического лиганда связь Bi –O – P – O – C8H17, в случае каприловой кислоты
Bi – O – C8H17. Или сравнить растворимость карбоната и фосфата?
2. Исследовать растворимость каприлата Bi6O4(OH)4R6?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.