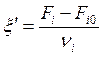 (моль/с), (2.5)
(моль/с), (2.5)
где ni0, ni - число молей i- го компонента в реакторе в начальный и рассматриваемый моменты [моль]; Fi0, Fi - расход i- го вещества на входе в реактор и выходе из реактора [моль/с].
Иногда ξ называют координатой реакции.
В
случае, если в системе одновременно протекает R реакций ![]() (
(![]() ,
,![]() ) величина ξj для каждой реакции определяется
следующим образом:
) величина ξj для каждой реакции определяется
следующим образом:
- для закрытой системы
![]() ; (2.6)
; (2.6)
- для открытой системы
![]() . (2.7)
. (2.7)
Химическая переменная ξj не зависит от компонента, участвующего в реакции, но зависит от того, к какой реакции относится. В случае одновременно протекающих реакций для определения R величин ξj необходимо рассмотреть систему из R уравнений (2.6) или (2.7). Если же величины ξj известны, то легко определить изменение в результате химических превращений количества любого из S компонентов на основе уравнений (2.8) или (2.9).
Условие постоянства объема или расхода при протекании химической реакции в изотермическом реакторе
![]()
![]() , то есть расход постоянен,
если сумма стехиометрических коэффициентов равна нулю для каждой реакции
, то есть расход постоянен,
если сумма стехиометрических коэффициентов равна нулю для каждой реакции
![]() .
.
Или, если ![]() ,
,
![]() .
.
2.3 Степень превращения (Xi)
Степень превращения (Xi) - характеризует относительное изменение содержания i-го компонента в результате химических реакций (относительную глубину переработки исходного продукта).
Для закрытой системы (периодический реактор)
 или
или 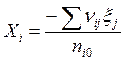 ;
; ![]() . (2.8)
. (2.8)
Для открытой системы (проточный реактор)
 ,
, 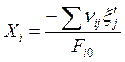 . (2.9)
. (2.9)
В литературе величина Xi имеет второе эквивалентное название - конверсия.
2.4 Селективность Si,i¢
Рассмотрим
селективность Si,i¢ процесса превращения исходного вещества i' в продукт i.
Различают интегральную селективность и мгновенную. Обычно интегральная мольная
селективность определяется как отношение количества (в молях) исходного
вещества ![]() , необходимого для образования
определенного количества целевого продукта
, необходимого для образования
определенного количества целевого продукта ![]() в
случае идеального процесса (без образования побочных веществ), к количеству
вещества
в
случае идеального процесса (без образования побочных веществ), к количеству
вещества ![]() , затраченному фактически в рассматриваемом
процессе при получении того же количества
, затраченному фактически в рассматриваемом
процессе при получении того же количества ![]() целевого
продукта.
целевого
продукта.
Для закрытых и открытых систем соответственно из этого определения следует:
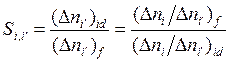 ; (2.10)
; (2.10)
 , (2.11)
, (2.11)
где i' - исходное; i - продукт; id - идеальный; f - фактический. Эти формулы соответствуют и другому определению селективности, в соответствии с которым величина селективности определяется как доля вещества i, образовавшегося из (при участии) вещества i' на практике от того количества вещества i, которое получилось бы в идеале, из того же количества вещества i', если бы вещество i' расходовалось только на целевой продукт.
Формулы
(2.10) и (2.11) удобны тем, что отношения ![]() ,
, ![]() можно определить из стехиометрического
уравнения, а фактические изменения
можно определить из стехиометрического
уравнения, а фактические изменения ![]() и
и ![]() могут быть определены экспериментально.
могут быть определены экспериментально.
Пример. Рассмотрим процесс окисления сероводорода в предположении, что только две простые реакции могут иметь место:
2nH2S + nO2 = 2Sn + 2nH2O; (2.12)
2H2S + 3O2 = 2SO2 + 2H2O. (2.13)
Рассчитаем селективность окисления сероводорода в серу в данном случае.
Сделаем
переобозначения: ![]() ,
, ![]() ,
, ![]() ,
, ![]() . Пусть
фактическое изменение числа молей сероводорода
. Пусть
фактическое изменение числа молей сероводорода ![]() ,
фактическое изменение числа молей серы
,
фактическое изменение числа молей серы ![]() . При
идеальной ситуации протекает единственная целевая реакция (2.12), поэтому в
соответствии с (2.7)
. При
идеальной ситуации протекает единственная целевая реакция (2.12), поэтому в
соответствии с (2.7)
![]() ,
, ![]() ,
,
![]() .
.
Следовательно, интегральная селективность
![]() . (2.14)
. (2.14)
Таким образом, селективность характеризует процессы, в которых протекает несколько химических реакций или стадий, благодаря чему исходный реагент может превращаться в разные продукты (побочные и целевые), и указывает эффективность течения процесса в рассматриваемом направлении (в направлении целевого продукта).
Мгновенная
селективность (![]() ) определяется аналогичным образом при
рассмотрении бесконечно малых изменений
) определяется аналогичным образом при
рассмотрении бесконечно малых изменений ![]() и
и ![]() , т.е., чтобы записать соотношения для
, т.е., чтобы записать соотношения для ![]() , достаточно в (2.10), (2.11) заменить
, достаточно в (2.10), (2.11) заменить ![]() и
и ![]() на dn
и dF (или на dn/dt и dF/dt) соответственно:
на dn
и dF (или на dn/dt и dF/dt) соответственно:
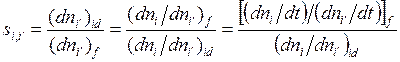 ; (2.15)
; (2.15)
 . (2.16)
. (2.16)
2.5 Выход продукта Ri,i¢
Выход
продукта ![]() - определяется как отношение количества
полученного продукта к теоретически возможному (стехиометрическому или
равновесному), т.е.
- определяется как отношение количества
полученного продукта к теоретически возможному (стехиометрическому или
равновесному), т.е.
![]() . (2.17)
. (2.17)
Следовательно, для рассмотренного в п. 2.4. примера
 . (2.18)
. (2.18)
Вместо рассмотренных молярных селективности и выхода можно ввести аналогичные понятия в терминах массы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.