- выделение целевых (полезных) продуктов заданной чистоты из полученных смесей;
- утилизация (или сбор и хранение) побочных продуктов с учетом экологических требований;
- дополнительные стадии, связанные с энергетическим обеспечением процесса (сжигание топлива и т.п.).
Основные требования к химико-технологическому производству - получение химических продуктов с максимальной экономической и экологической эффективностью.
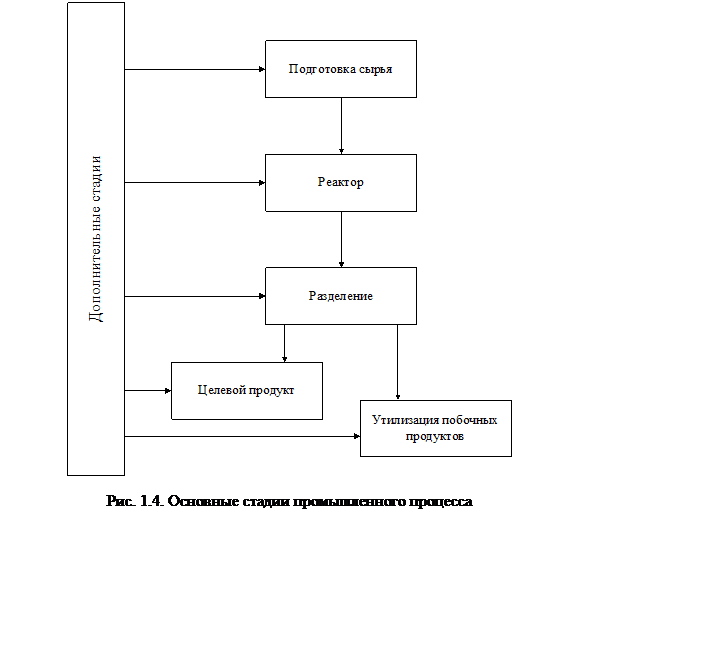
Очевидно, что в общем случае нецелесообразно рассматривать вопрос об оптимизации работы химического реактора отдельно от всей химико-технологической системы. Действительно, наиболее подходящие условия реализации химической стадии могут оказаться неприемлемыми с точки зрения эффективности всей технологической системы из-за непомерных затрат на подготовку исходных реагентов (может потребоваться прецизионная очистка или сверхвысокая концентрация сырья) или из-за наличия трудноотделяемых веществ в продуктах реакции, получения низкоконцентрированных по целевому продукту смесей, трудностей отделения целевого продукта, и других стадий, которые будут вносить решающий вклад в экономику производства в целом.
Вместе с тем, химический реактор является сердцем химико-технологической системы, в значительной степени определяющим ее принципиальные особенности. Основные задачи теории химических реакторов состоят в создании адекватных математических моделей и методов расчета реакторов и реализуемых в них процессов, позволяющих анализировать устойчивость режимов работы реакторов, находить корреляции между основными показателями эффективности работы реактора и его режимными и конструкционными параметрами, оптимизировать режим работы реактора и его конструкцию при наличии ограничений на входные и выходные характеристики реактора.
В свете изложенного основные этапы разработки и создания химических реакторов можно представить в виде схемы, изображенной на рисунке 1.5.
Из этой схемы видно, что расчет химического реактора основывается (и это станет хорошо понятно дальше) на учете термодинамических и кинетических особенностей собственно химической реакции (условия химического равновесия, анализ возможных маршрутов реакций, скорости химических превращений, теплот реакций) и рассмотрении влияния физических процессов (гидроаэродинамики и тепломассопереноса) на условия протекания химических реакций в различных точках объема реактора и интегральные показатели реактора в целом.
Математические модели химических реакторов представляют собой в общем случае системы нелинейных дифференциальных уравнений, выражающих балансы массы, энергии, импульса для всего потока или его отдельных частей (компонентов, фаз, зерна катализатора и т.д.). В зависимости от степени детализации протекающих в реакторе процессов математические модели могут отличаться по сложности. Преимущество простых моделей - наглядность представления и анализа принципиальных особенностей поведения реактора. Необходимость усложнения моделей обусловлена стремлением получить количественные результаты и отразить наиболее важные частные эффекты, имеющие преобладающее значение для конкретных процессов.

2 Основные понятия и определения, характеризующие химические процессы в реакторе
2.1 Стехиометрические уравнения
Стехиометрические уравнения - это химические уравнения, отражающие соотношение количеств молекул (реагентов и продуктов), участвующих в рассматриваемой реакции. Например,
2H2 + O2 = 2H2O, или 2H2O - 2H2 – O2 = 0. (2.1)
В общем виде такое уравнение выглядит следующим образом:
![]() ,
, ![]() . (2.2)
. (2.2)
Здесь Ai - компонент i (молекула вида i); S - общее число компонентов, участвующих в данной реакции; νi – стехиометрический коэффициент (для унификации расчетов принимается, что νi < 0 - для реагентов; νi > 0 - для продуктов реакции, νi = 0 – для вещества, не участвующего в данной реакции).
Если в ректоре протекает одновременно несколько реакций, то их набор записывается следующим образом
![]() ,
, ![]() ,
, ![]() . (2.3)
. (2.3)
Здесь и далее ∑ - означает суммирование по повторяющимся индексам (в
частности, ![]() ) Ai - i-й компонент из полного набора S
компонентов, участвующих во всех R реакциях, R - число
одновременно протекающих реакций.
) Ai - i-й компонент из полного набора S
компонентов, участвующих во всех R реакциях, R - число
одновременно протекающих реакций.
2.2 Химическая переменная (ξ)
В
случае единственной реакции ![]() (νi < 0 - для реагентов; νi > 0 - для продуктов реакции) ξ
определяется следующим образом:
(νi < 0 - для реагентов; νi > 0 - для продуктов реакции) ξ
определяется следующим образом:
- для закрытой системы (не имеется материального обмена с окружающей средой - периодический реактор)
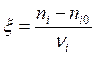 (моль); (2.4)
(моль); (2.4)
- для открытой системы (проточный реактор)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.