











этилбензола; тогда количество его в газовой фазе,
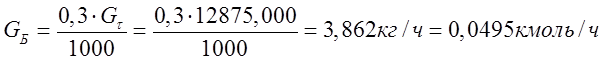 (11)
(11)
Количество и состав отходящих газов приводится в таблице, аналогичной табл.2.
Таблица 2
Количество и состав отходящих газов
|
Компонент |
ni, кмоль/ч |
хi,% |
mi, кг/ч |
|
СН4 |
40,727 |
38,653 |
651,635 |
|
С2Н4 |
1,598 |
1,517 |
44,749 |
|
С2Н6 |
45,502 |
43,184 |
1365,062 |
|
С6Н6 |
0,0495 |
0,047 |
3,862 |
|
Н2 |
4,213 |
3,998 |
117,968 |
|
N2 |
9,831 |
9,330 |
275,259 |
|
О2 |
1,404 |
1,332 |
44,940 |
|
СО |
2,0223 |
1,919 |
56,624 |
|
HCl |
0,02077 |
0,0197 |
0,748 |
|
Cумма: |
105,367 |
100,000 |
2560,847 |
Значения n и m для метана, этана, водорода, азота и кислорода переносятся в табл. 2 из табл.1. Значения для хлорида водорода, этилена, оксида углерода и бензола - расчетные, они определяются из уравнений и формул (8)....(11).
Для определения состава алкилата рассчитывают изменение состава сырьевой смеси в процессе алкилирования.
По реакции переалкилирования:
С6Н4 - (С2Н5)2 + С6Н6 = 2 С6Н5 – С2Н5 (12)
расходуются
одинаковые количества (в размерности кмоль/час) диэтилбензола и бензола,
численно равные величине ![]() - см. уравнение (7).
- см. уравнение (7).
По
уравнению этой реакции необходимо определить количество получаемого этилбензола
в размерностях кмоль/час и кг/час. Естественно, в размерности кмоль/час это
количество равно удвоенной величине ![]()
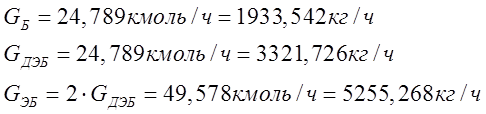
Следовательно, алкилированием бензола получают этилбензол:
![]() (13)
(13)
По уравнению целевой реакции (алкилирования бензола)
С6Н6 + С2Н4 = С6Н5 – С2Н5 (14)
с
учетом того, что количество продукта реакции - этилбензола - уже известно (![]() ), определяются количества исходных реагентов -
бензола и этилена (сначала в размерности кмоль/час, а потом в размерности
кг/час). Очевидно, что количества бензола и этилена в размерности кмоль/час
численно равны величине
), определяются количества исходных реагентов -
бензола и этилена (сначала в размерности кмоль/час, а потом в размерности
кг/час). Очевидно, что количества бензола и этилена в размерности кмоль/час
численно равны величине ![]()
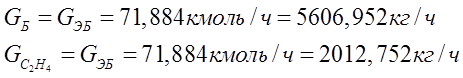
По реакции
С6Н6+ 2 С2Н4 = С6Н4 - (С2Н5)2 (15)
расходуется
38,2% от поступающего этилена, что составляет 0,382 ![]() кмоль/час. Очевидно, что численные значения (в этой
размерности) для бензола и диэтилбензола вдвое меньше. Далее все эти три
величины определяются в размерности кг/час.
кмоль/час. Очевидно, что численные значения (в этой
размерности) для бензола и диэтилбензола вдвое меньше. Далее все эти три
величины определяются в размерности кг/час.
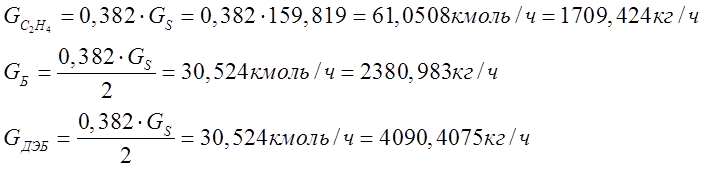
По реакции:
С6Н6 + 3 С2Н4= С6Н3 - (С2Н5)3 (16)
расходуется 11% от поступающего этилена, что составляет 0,11Gs кмоль/час. Очевидно, что численные значения (в этой размерности) для бензола и триэтилбензола втрое меньше. Далее все эти три величины определяются в размерности кг/час.
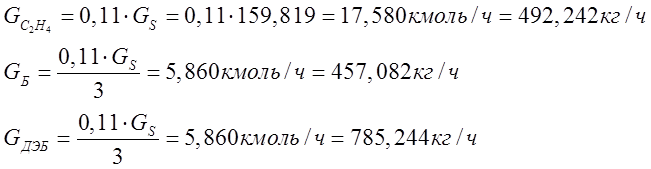
На реакцию
С6Н6 + 4 С2Н4= С6Н2 - (С2Н5)4 (17)
расходуется оставшийся этилен (исходное количество Gs за вычетом содержания в отходящих газах и расхода в реакциях №№ 14... 16 в размерности кмоль/час). Очевидно, что численные значения (в этой размерности) для бензола и тетраэтилбензола вчетверо меньше. Далее все три эти величины определяются в размерности кг/час.
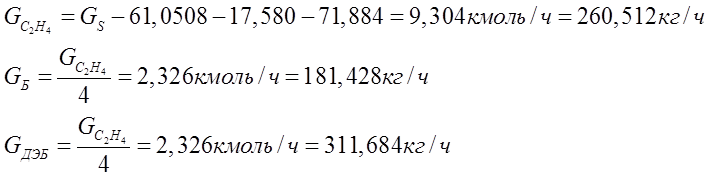
На реакцию
С6Н6 + С3Н6= С6Н5 – С3Н7 (18)
расходуется весь пропилен, содержащийся в этиленовой фракции - табл. 1. Обозначим его количество. Очевидно, что применительно к этой реакции численные значения в размерности кмоль/час для бензола, пропилена и изопропилбензола должны совпадать. Далее все эти три величины определяются в размерности кг/час.
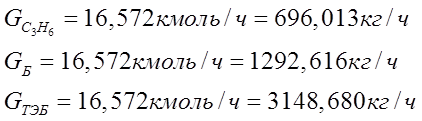 (мольная масса тетраэтилбензола 190)
(мольная масса тетраэтилбензола 190)
На реакцию
2 С6Н6 + С2Н2= С2Н4 - (С6Н5)2 (19)
расходуется
весь ацетилен, содержащийся в этиленовой фракции - табл. 1. Обозначим его
количество![]() . Очевидно, что применительно к
этой реакции численные значения в размерности кмоль/час для ацетилена и
дифенилэтана должны совпадать; для бензола это значение вдвое больше. Далее все
эти три величины определяются в размерности кг/час.
. Очевидно, что применительно к
этой реакции численные значения в размерности кмоль/час для ацетилена и
дифенилэтана должны совпадать; для бензола это значение вдвое больше. Далее все
эти три величины определяются в размерности кг/час.
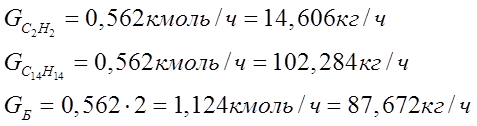 (мольная масса дифенилэтана 182)
(мольная масса дифенилэтана 182)
На реакцию
2 С6Н6 + СО= (С6Н5)2-СНОН (20)
расходуется 10 % оксида углерода, содержащегося в этиленовой фракции - табл. 1. Обозначим его количество Gco. Очевидно, что применительно к этой реакции численные значения в размерности кмоль/час для оксида углерода и дифенилкарбинола должны совпадать; для бензола это значение вдвое выше. Далее все эти три величины определяются в размерности кг/час.
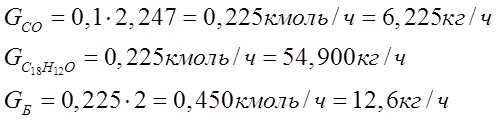 (мольная масса дифенилкарбинола 244)
(мольная масса дифенилкарбинола 244)
На следующем этапе определяется общий расход бензола GБ.Общ, по всем восьми реакциям (№№ 12, 14...20) в размерностях кмоль/час (кг/час). Помимо этого, часть бензола GБ удаляется с отходящми газами. Оставшийся бензол (количество его определяется в размерностях кмоль/час и кг/час) переходит в алкилат:
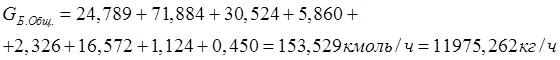
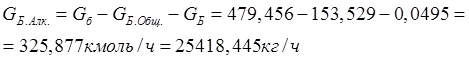
(21)
В алкилат поступают также оставшийся после гидролиза по реакции (8) хлорид алюминия и продукт его гидролиза - гидроксид алюминия
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.