




заданий студенты приобретают навыки по работе с данными химических справочников).
Домашнее задание к лабораторной работе № 1.“ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ”
Задание 1. Дано уравнение реакции (см. ваш вариант в табл. 1).
1.Найдите в прил. 1 стандартные энтальпии образования ∆2H0 (298К) и
стандартные энтропии S0 (298К) для всех веществ, участвующих в реакции.
2.Вычислите изменения энтальпии и энтропии при протекании прямой реакции в стандартных условиях. Сделайте вывод, экзо- или эндотермическая данная реакция и объясните знак ∆ rS.
3.Вычислите энергию Гиббса прямой реакции в стандартных условиях
∆r G0 (298К) и установите направление самопроизвольного протекания реакции.
4.Определите температуру, при которой реакция находится в равновесии (ТР).
5.Рассчитайте ∆ rG0 при Т=Т0-100 и Т=Т0+100 и постройте график зависимости ∆rG0 от Т. Определите область температур самопроизвольного протекания реакции и вещество – восстановитель.
6. Вычислите значения константы равновесия (К) для температур:
Т1 = Тр0C , Т2 = Тр +1000C , Т=Тр – 1000C. Сделайте вывод о влиянии температуры на величину К и на смещение равновесия.
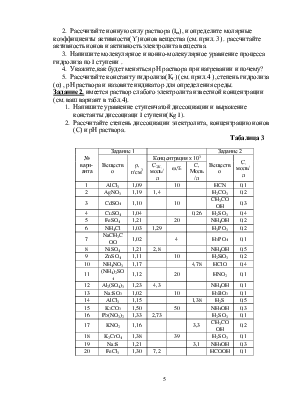
Таблица 1
|
№ вари- анта |
Задание № |
||||
|
1, 2 |
3 |
||||
|
С(А), моль/л |
|||||
|
τ = 0 |
τ = 1 |
τ=2,5 |
τ=5,5 |
||
|
1 |
CH4+2H2O→CO2+4H2 |
27 |
20 |
10 |
3.2 |
|
2 |
CO+H2O(Г) →CO2+H2 |
30 |
22 |
11 |
3.5 |
|
3 |
N2+3H2→2NH3 |
33 |
24 |
12 |
3.8 |
|
4 |
3С2 H2(г) →C6H6(г) |
35 |
26 |
13 |
4,2 |
|
5 |
СO2+CaO(k) →CaCO3(k) |
38 |
28 |
14 |
4,5 |
|
6 |
C2H4(г)+H2→C2H6(г) |
108 |
80 |
40 |
12,8 |
|
7 |
2NO2→N2O4(г) |
119 |
88 |
44 |
14,1 |
|
8 |
2NO+O2→2NO2 |
130 |
96 |
48 |
15,4 |
|
9 |
CH4+2O2→CO2+2H2O(г) |
140 |
104 |
52 |
16,6 |
|
10 |
2CO+O2→2CO2 |
151 |
112 |
56 |
17,9 |
|
11 |
CH4+4Cl2→CCl4(г)+4HCl(г) |
41 |
30 |
15 |
4,8 |
|
12 |
BaO(k)+CO2→BaCO3(k) |
43 |
32 |
16 |
5,1 |
|
13 |
C2H4+H2O(г) →C2H5OH(ж) |
49 |
36 |
18 |
5.8 |
|
14 |
СO2+4H2(г) →СH4+2H2O(г) |
54 |
40 |
20 |
6,4 |
|
15 |
NH3(г)+HCl(г) →NH4Cl(г) |
60 |
44 |
22 |
7 |
|
16 |
4HCl(г) +O2→2H2O(г)+2Сl2 |
162 |
120 |
60 |
19,2 |
|
17 |
2PbO(к)+O2→2PbO2(k) |
178 |
132 |
66 |
21 |
|
18 |
CuO(k)+SO3(г) →CuSO4(k) |
24 |
18 |
9 |
2,9 |
|
19 |
NH3(г)+H2O(ж) →NH4OH(Ж) |
22 |
16 |
8 |
2,6 |
|
20 |
C2H2(г)+2H2→C2H6(г) |
19 |
14 |
7 |
2,3 |
Домашнее задание к лабораторной работе № 2. «Скорости химических реакций»
Задание 1.
Дано уравнение реакции (см. ваш вариант в табл.1)
1. Напишите термохимическое уравнение реакции.
2. Запишите кинетические уравнения скоростей прямой и обратной реакции.
3. рассчитайте увеличение скорости прямой реакции при одновременном повышении давления в 2 раза и температуры на 20° C (g=2).
4. Запишите выражение для константы равновесия химической реакции через концентрации (К) . используя зависимость Рi =CiRT, запишите выражение константы равновесия через парциальные давления (Рi) исходных веществ и продуктов реакции (Кp) .
5. Предложите условия ,при которых выход продуктов будет максимален .
Задание 2. Гетерогенная реакция при Т=300К протекает по одной из схем:
а) А(г) + B(k) = AB(k) ;
б) 2А(г) + В(к) = АВ(к) .
СА приведены в табл. 3.
1.Постройте график зависимости концентрации вещества А(СА) от времени τ ( см. Ваш вариант в табл. 3).
Из графика определите период полураспада τ ½ и истинную скорость υ для τ = 2; 3; 4; 5 минут.
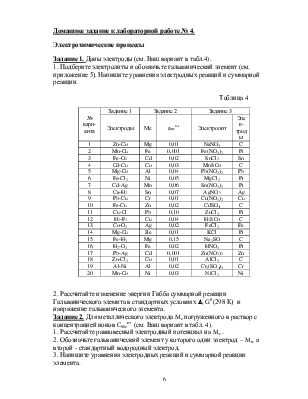
Таблица 2
|
ри- № вари-анта |
Задание 2 |
|||||
|
m,r |
C0,моль/л |
|||||
|
1 |
2 |
3 |
4 |
5 |
||
|
1 |
0,90 |
0,010 |
0,023 |
0,065 |
0,200 |
0,698 |
|
2 |
0,60 |
0,005 |
0,015 |
0,050 |
0,180 |
0,670 |
|
3 |
2,00 |
0,030 |
0,045 |
0,084 |
0,212 |
0,695 |
|
4 |
0,90 |
0,012 |
0,024 |
0,060 |
0,186 |
0,665 |
|
5 |
0,40 |
0,004 |
0,014 |
0,047 |
0,173 |
0,662 |
|
6 |
0,180 |
0,008 |
0,018 |
0,050 |
0,172 |
0,645 |
|
7 |
0,40 |
0,003 |
0,013 |
0,046 |
0,173 |
0,654 |
|
8 |
0,70 |
0,005 |
0,014 |
0,045 |
0,168 |
0,637 |
|
9 |
0,60 |
0,010 |
0,021 |
0,054 |
0,180 |
0,655 |
|
10 |
0,50 |
0,005 |
0,015 |
0,047 |
0,167 |
0,645 |
|
11 |
0,60 |
0,007 |
0,016 |
0,047 |
0,168 |
0,639 |
|
12 |
0,50 |
0,008 |
0,017 |
0,048 |
0,169 |
0,642 |
|
13 |
0,70 |
0,005 |
0,014 |
0,045 |
0,167 |
0,639 |
|
14 |
0,95 |
0,011 |
0,025 |
0,067 |
0,204 |
0,705 |
|
15 |
0,65 |
0,005 |
0,016 |
0,052 |
0,182 |
0,674 |
|
16 |
2,00 |
0,033 |
0,048 |
0,088 |
0,217 |
0,702 |
|
17 |
0,95 |
0,013 |
0,026 |
0,062 |
0,189 |
0,678 |
|
18 |
0,75 |
0,011 |
0,030 |
0,079 |
0,242 |
0,806 |
|
19 |
0,85 |
0,009 |
0,019 |
0,051 |
0,173 |
0,646 |
|
20 |
0,60 |
0,005 |
0,018 |
0,055 |
0,190 |
0,696 |
2. Постройте график зависимости lgV=f(lgCA ) и определите частный порядок реакции по веществу А( nA). Исходя из величины nA, рассчитайте t½ .
3. Сопоставьте значения t½, полученные в пп.1 и 2.Сделайте вывод, какая из реакций (“a” или “б”) соответствует вашим результатам по nA.
4. Найдите константу скорости К(300 К) из графика зависимости lgV=f (lgCA) . Используя значения К (300К) и температурного коэффициента ϒ=2 , рассчитайте энергию активности ЕА .
5. Определите лимитирующую стадию (диффузионная или кинетическая ) реакции на основании величин ЕА .
Домашнее задание к лабораторной работе № 3.
«Растворы электролитов»
Задание 1. Имеется раствор вещества данной концентрации и плотности (см. ваш вариант в табл.3).
1. Определите концентрацию вещества (С), молярную концентрацию эквивалентов вещества (СЭК) ,массовую долю растворенного вещества (ω) в процентах и молярность вещества (Сm) в растворе .
2. Рассчитайте ионную силу раствора (Im), и определите молярные коэффициенты активности(ϒ) ионов вещества (см. прил. 3) . рассчитайте активность ионов и активность электролита вещества.
3. Напишите молекулярное и ионно-молекулярное уравнение процесса гидролиза по I ступени .
4. Укажите,как будет меняться рН раствора при нагревании и почему?
5. Рассчитайте константу гидролиза(КГ) (см. прил.4 ) ,степень гидролиза (α) , рН раствора и назовите индикатор для определения среды.
Задание 2. имеется раствор слабого электролита известной концентрации (см. ваш вариант в табл.4).
1. Напишите уравнение ступенчатой диссоциации и выражение константы диссоциаци I ступени(Kg I).
2. Рассчитайте степень диссоциации электролита, концентрацию ионов (С) и рН раствора.
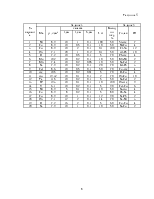
Табалица 3
|
№ вари-анта |
Задание 1 |
Задание 2 |
|||||
|
Вещество |
r, г/см3 |
Концентрация х 103 |
Вещество |
С, моль/л |
|||
|
СЭК, моль/л |
w,% |
C, Моль/л |
|||||
|
1 |
AlCl3 |
1,09 |
10 |
HCN |
0,1 |
||
|
2 |
AgNO3 |
1,19 |
1,4 |
H2CO3 |
0,2 |
||
|
3 |
CdSO4 |
1,10 |
10 |
CH3COOH |
0,3 |
||
|
4 |
CuSO4 |
1,04 |
0,26 |
H2SO3 |
0,4 |
||
|
5 |
FeSO4 |
1,21 |
20 |
NH4OH |
0,2 |
||
|
6 |
NH4Cl |
1,03 |
1,29 |
H3PO3 |
0,2 |
||
|
7 |
NaCH3COO |
1,02 |
4 |
H3PO4 |
0,1 |
||
|
8 |
NiSO4 |
1,21 |
2,8 |
NH4OH |
0,5 |
||
|
9 |
ZnSO4 |
1,11 |
10 |
H2SiO3 |
0,2 |
||
|
10 |
NH4NO3 |
1,17 |
4,78 |
HClO |
0,4 |
||
|
11 |
(NH4)2SO4 |
1,12 |
20 |
HNO2 |
0,1 |
||
|
12 |
Al2(SO4)3 |
1,23 |
4,3 |
NH4OH |
0,1 |
||
|
13 |
Na2SO3 |
1,02 |
10 |
H3BO3 |
0,1 |
||
|
14 |
AlCl3 |
1,15 |
1,38 |
H2S |
0,5 |
||
|
15 |
K2CO3 |
1,50 |
50 |
NH4OH |
0,3 |
||
|
16 |
Pb(NO3)2 |
1,33 |
2,73 |
H2SO3 |
0,1 |
||
|
17 |
KNO2 |
1,16 |
3,3 |
CH3COOH |
0,2 |
||
|
18 |
K2CrO4 |
1,38 |
39 |
H2SO3 |
0,1 |
||
|
19 |
Na2S |
1,21 |
3,1 |
NH4OH |
0,3 |
||
|
20 |
FeCl3 |
1,30 |
7,2 |
HCOOH |
0,1 |
||
Домашнее задание к лабораторной работе № 4.
Электрохимические процессы
Задание 1. Даны электроды (см. Ваш вариант в табл.4).
1. Подберите электролиты и обозначьте гальванический элемент (см. приложение 5). Напишите уравнения электродных реакций и суммарной реакции.
Таблица 4
|
№ вари- анта |
Задание 1 |
Задание 2 |
Задание 3 |
||
|
Электроды |
Ме |
амеn+ |
Электролит |
Элек-троды |
|
|
1 |
Zn-Co |
Mg |
0,01 |
NaNO3 |
C |
|
2 |
Mn-Cu |
Fe |
0,001 |
Fe(NO3)2 |
Pt |
|
3 |
Fe-O2 |
Cd |
0,02 |
SnCl2 |
Sn |
|
4 |
Cd-Cu |
Co |
0,03 |
MnSO4 |
C |
|
5 |
Mg-Co |
Al |
0,04 |
Pb(NO3)2 |
Pb |
|
6 |
Fe-Cl2 |
Ni |
0,05 |
MgCl2 |
Pt |
|
7 |
Cd-Ag |
Mn |
0,06 |
Sn(NO3)2 |
Pt |
|
8 |
Ca-H2 |
Sn |
0,07 |
AgNO3 |
Ag |
|
9 |
Pb-Cu |
Cr |
0,01 |
Cu(NO3)2 |
Cu |
|
10 |
Fe-Cu |
Zn |
0,02 |
CdSO4 |
C |
|
11 |
Cu-Cl |
Pb |
0,10 |
ZnCl2 |
Pt |
|
12 |
H2-F2 |
Cu |
0,04 |
H2SO4 |
C |
|
13 |
Co-O2 |
Ag |
0,02 |
FeCl2 |
Fe |
|
14 |
Mg-Cu |
Be |
0,01 |
KCl |
Pt |
|
15 |
Fe-H2 |
Mg |
0,15 |
Na2SO |
C |
|
16 |
H2-O2 |
Fe |
0,02 |
HNO3 |
Pt |
|
17 |
Pb-Ag |
Cd |
0,001 |
Zn(NO3)2 |
Zn |
|
18 |
Zn-Cl2 |
Co |
0,01 |
AlCl3 |
C |
|
19 |
Al-Ni |
Al |
0,02 |
Cr2(SO4)3 |
Cr |
|
20 |
Mn-Co |
Ni |
0,03 |
NiCl2 |
Ni |
2. Рассчитайте изменение энергии Гибба суммарной реакции Гальванического элемнта в стандартных условиях
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.