1. Пересчитать составы заданных сухих газов с поправкой на влажность по формулам (3), (4).
2. Принять объемную долю первого газа в смеси за х, а долю второго газа за (1-х). Тогда
![]() , откуда
, откуда
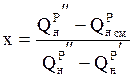 .
.
Величины ![]() и
и ![]() ,
теплоты сгорания первого и второго газов, рассчитываются по формуле (1).
,
теплоты сгорания первого и второго газов, рассчитываются по формуле (1).
3. Рассчитать состав смешанного газа:
Например, СО2
см = ![]() ·х +
·х + ![]() ·( 1–
х) и т.д., (8)
·( 1–
х) и т.д., (8)
где СО2 см – содержание компонента в смеси;
![]() – содержание компонента в первом газе;
– содержание компонента в первом газе;
![]() – содержание компонента во втором газе.
– содержание компонента во втором газе.
Составы сухих газов (природного, коксового и доменного) приведены в [1, таблицы 6-8].
Состав твердого и жидкого топлива может быть задан органической, горючей или сухой массой. Перед расчетом горения заданный состав необходимо пересчитать на рабочую массу по одной из следующих формул:
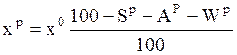 ,
,
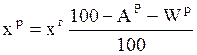 , (9)
, (9)
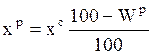 .
.
Здесь хо, хг, хс, хр – содержание элемента топлива соответственно в органической, горючей, сухой и рабочей массе, масс.%;
Sр, Ар, Wр – содержание серы, золы и влаги в рабочей массе топлива (по данным технического анализа), масс.%.
Обратный пересчет можно осуществить по тем же формулам (9). Данные элементарного и технического анализа твердого и жидкого топлива представлены в [1, таблицы 11, 14].
2.4 Определение теоретического (![]() ) и действительного (
) и действительного (![]() ) количества воздуха для горения
) количества воздуха для горения
Расчет основан на анализе термохимических реакций окисления составляющих топлива, записанных для 1 кмоля горючего:
С + О2 = СО2,
S + O2 = SO2,
H2 + ![]() O2 = H2O,
O2 = H2O,
CO + ![]() O2 = СО2,
O2 = СО2,
H2S + ![]() O2 = H2O
+ SO2,
O2 = H2O
+ SO2,
CH4 + 2O2 = СО2 + 2 H2O и т.д.
Например, для
сжигания 1 м3 (или 1 кмоля) CH4
необходимо 2 м3 (2 кмоля) O2. С
этим количеством O2 внесется 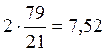 (м3 или кмоля) N2. Теоретическое количество воздуха
(м3 или кмоля) N2. Теоретическое количество воздуха ![]() , необходимого для полного сжигания 1 м3
(кмоля) CH4, составляет 9,52 м3
(кмоля).
, необходимого для полного сжигания 1 м3
(кмоля) CH4, составляет 9,52 м3
(кмоля).
Порядок
расчета ![]() и
и ![]() следующий
[3]: зная состав топлива и записав соответствующие реакции окисления горючих
составляющих, можно подсчитать общий расход кислорода как сумму расходов
кислорода, необходимого для сжигания отдельных горючих составляющих топлива (в
следующий
[3]: зная состав топлива и записав соответствующие реакции окисления горючих
составляющих, можно подсчитать общий расход кислорода как сумму расходов
кислорода, необходимого для сжигания отдельных горючих составляющих топлива (в
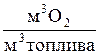 ):
):
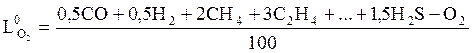 , (10)
, (10)
где СО, H2, CH4, C2H4, H2S – содержание горючих составляющих топлива, об.%;
О2 – содержание О2 в топливе, об. %;
0,5; 1,5; 2,0; 3,0 – стехиометрические коэффициенты в уравнении реакции.
Тогда теоретическое количество воздуха для горения
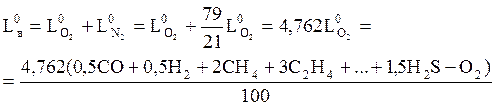 . (11)
. (11)
На практике
для более полного сжигания топлива в зону горения подается воздуха больше, чем
это требуется по стехиометрическим соотношениям: ![]() >
>![]() . Отношение действительного количества
воздуха к теоретическому называется коэффициентом расхода воздуха: n =
. Отношение действительного количества
воздуха к теоретическому называется коэффициентом расхода воздуха: n =![]() /
/ ![]() .
.
Численное значение коэффициента расхода воздуха принимается в зависимости от вида топлива и условий его сжигания (таблица 3) [4].
Рассчитав по
формуле (11) ![]() и приняв значение n,
можно определить действительное количество воздуха:
и приняв значение n,
можно определить действительное количество воздуха:
![]() = n ·
= n · ![]() . (12)
. (12)
При
определении величин ![]() и
и ![]() для
твердого и жидкого топлива необходимо сначала сделать пересчет состава топлива,
выраженного в массовых процентах, на молярный. Это связано с тем, что для
твердого и жидкого топлива объемные доли и процентные содержания компонентов топлива
не совпадают, как это имеет место для газообразного топлива. Для пересчета на
молярный состав необходимо процентные содержания составляющих топлива поделить
на их молекулярные массы, и расчет величин
для
твердого и жидкого топлива необходимо сначала сделать пересчет состава топлива,
выраженного в массовых процентах, на молярный. Это связано с тем, что для
твердого и жидкого топлива объемные доли и процентные содержания компонентов топлива
не совпадают, как это имеет место для газообразного топлива. Для пересчета на
молярный состав необходимо процентные содержания составляющих топлива поделить
на их молекулярные массы, и расчет величин ![]() и
и ![]() вести в кмолях, которые затем пересчитать
в объемные единицы (м3) умножением на vμ
= 22,4 м3/кмоль.
вести в кмолях, которые затем пересчитать
в объемные единицы (м3) умножением на vμ
= 22,4 м3/кмоль.
Таблица 3 – Значения рекомендуемых коэффициентов расхода воздуха в зависимости от вида топлива и условий его сжигания
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.