ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ 2
Расчет горения топлива
Расчет горения топлива необходим для того, чтобы правильно подобрать дутьевые и тяговые устройства к печи, обеспечивающие нормальный процесс горения, движения дымовых газов и необходимый температурный режим в рабочем пространстве печи.
Состав топлива (газ месторождения Уренгой-Ямал), мас.%: СН4 = 97,95; С2Н6 = 0,75; С3Н8 = 0,24; С4Н10 = 0,09; С5Н12 = 0,02; СО2 = 0,08; N2 = 0,87.
Пересчитаем состав газообразного топлива с сухой на рабочую массу:
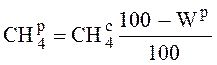 ,
(1.2П)
,
(1.2П)
где ![]() – содержание метана в
рабочем топливе, %;
– содержание метана в
рабочем топливе, %; ![]() – содержание метана в сухом
топливе, %; Wр –
содержание влаги в рабочем топливе, %.
– содержание метана в сухом
топливе, %; Wр –
содержание влаги в рабочем топливе, %.
Рабочий состав газа сводим в табл. 1.2П.
Таблица 1.2П
Рабочий состав газа, мас.%
|
|
|
|
|
|
|
|
|
Сумма |
|
96,97 |
0,74 |
0,24 |
0,09 |
0,02 |
0,08 |
0,86 |
1,0 |
100 |
Теплота сгорания газообразного топлива определяется как сумма произведений тепловых эффектов составляющих газа на их количество, выраженное в объемных процентах, кДж/м3:
![]() 358,2CН4 + 637,5С2Н6 +
912,5С3Н8 + 1186,5С4Н10 + 1460,8С5Н12
(2.2П)
358,2CН4 + 637,5С2Н6 +
912,5С3Н8 + 1186,5С4Н10 + 1460,8С5Н12
(2.2П)
![]() = 358,2
∙ 96 + 637,5 ∙ 0,74 + 912,5 ∙ 0,24 + 1186,5 ∙ 0,09 + 1460,8 ∙
0,02 =
= 358,2
∙ 96 + 637,5 ∙ 0,74 + 912,5 ∙ 0,24 + 1186,5 ∙ 0,09 + 1460,8 ∙
0,02 =
= 35561,41 кДж/м3
Расчет расхода воздуха, необходимого для горения
В расчетах принимаем следующий состав воздуха, по объему в %: азот –79 и кислород – 21. Количество влаги, вносимое атмосферным воздухом, значительно увеличивает расход воздуха.
Определяем теоретически необходимый для горения расход сухого воздуха:
L0 = 0,0476(2СН4 + 3,5С2Н6 + 5С3Н8 + 6,5С4Н10 + 8С5Н12) (3.2П)
L0 = 0,0476(2 ∙ 96,97 + 3,5 ∙ 0,74 + 5 ∙ 0,24 + 6,5 ∙ 0,09 + 8 ∙ 0,02 =9,45 м3/м3
Расход атмосферного воздуха при влагосодержании d г/кг сух. воздуха, м3/м3:
![]() = (1 +
0,0016d) L0
(4.2П)
= (1 +
0,0016d) L0
(4.2П)
При расчетах тепловых агрегатов влагосодержание атмосферного воздуха принимают 8–12,5 г/кг /16/.
![]() = (1 +
0,0016 ∙ 10) 9,45 = 9,60 м3/м3
= (1 +
0,0016 ∙ 10) 9,45 = 9,60 м3/м3
Практически для полного сгорания топлива требуется подвод воздуха в количестве, превышающем теоретически необходимое, так как трудно достигнуть идеального смешения воздуха с топливом.
Действительный расход сухого воздуха с учетом коэффициента расхода воздуха, м3/м3:
![]() , (5.2П)
, (5.2П)
где α – коэффициент избытка воздуха, показывающий отношение действительного количества воздуха, введенного для горения, к теоретически необходимому:
α = Lα / L0
Коэффициент расхода воздуха:
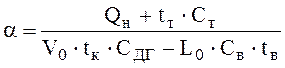 ,
(6.2П)
,
(6.2П)
где tт – температура топлива, °С; Ст – объемная теплоемкость топлива, кДж/(м3 · К); V0 – общий объем дымовых газов, м3/м3; tк – калориметрическая температура горения, °С; Сдг – объемная теплоемкость дымовых га-зов, кДж/(м3 · К); Св – объемная теплоемкость воздуха, поступающего на горение топлива, кДж/(м3 · К); tв – температура воздуха, поступающего на горение топлива, °С.
Объемная теплоемкость газообразного топлива, кДж/(м3 · К):
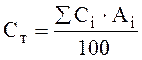 ,
(7.2П)
,
(7.2П)
где Сi – объемная теплоемкость составляющих топлива (СН4, СО2 и др.), кДж/(м3 · К), при температуре tт /15, прилож. 4/; Аi – содержание составляющих топлива, выраженное в объемных процентах, %.
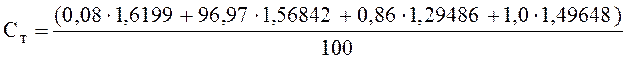 =
=
= 1,55 кДж/(м3 ∙ К)а на их количество, выраженное в объемных процентах
Общий объем дымовых газов при сжигании топлива с теоретически необходимым количеством воздуха, т.е. при α = 1, м3/м3:
![]() (8.2П)
(8.2П)
Объемы отдельных составляющих продуктов горения газообразного топлива, м3/м3:
![]() =
0,01(СО2 + СН4 + 2С2Н6 + 3С3Н8
+ 4С4Н10 + 5С5Н12,
(9.2П)
=
0,01(СО2 + СН4 + 2С2Н6 + 3С3Н8
+ 4С4Н10 + 5С5Н12,
(9.2П)
![]() =
0,01(0,08 + 96,97 + 2 ∙ 0,74 + 3 ∙ 0,24 + 4 ∙ 0,09 + 5 ∙ 0,02 = 0,997м3/м3
=
0,01(0,08 + 96,97 + 2 ∙ 0,74 + 3 ∙ 0,24 + 4 ∙ 0,09 + 5 ∙ 0,02 = 0,997м3/м3
![]() = 0,01(2СН4 +
3С2Н6 + 4С3Н8 + 5С4Н10
+ 6С5Н12 + Н2О + 0,16d ∙ L0), (10.2П)
= 0,01(2СН4 +
3С2Н6 + 4С3Н8 + 5С4Н10
+ 6С5Н12 + Н2О + 0,16d ∙ L0), (10.2П)
![]() = 0,01(2 ∙ 96,97 + 3 ∙ 0,74 + 4 ∙ 0,24 + 5
∙ 0,09 + 6 ∙ 0,02 + 1,0 + 0,16 ∙ 10 ∙ 9,45) = 2,14 м3/м3
= 0,01(2 ∙ 96,97 + 3 ∙ 0,74 + 4 ∙ 0,24 + 5
∙ 0,09 + 6 ∙ 0,02 + 1,0 + 0,16 ∙ 10 ∙ 9,45) = 2,14 м3/м3
![]() = 0,79L0 + 0,01N2,
(11.2П)
= 0,79L0 + 0,01N2,
(11.2П)
![]() = 0,79 ∙ 9,45 + 0,01 ∙ 0,86 = 7,48м3/м3
= 0,79 ∙ 9,45 + 0,01 ∙ 0,86 = 7,48м3/м3
Общий объем дымовых газов равен:
V0 = 0,997 + 2,14 + 7,48 = 10,62 м3/м3
Необходимая теплота подогрева воздуха, кДж/м3:
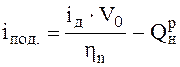 ,
(12.2П)
,
(12.2П)
где iд – тепло продуктов сгорания топлива для заданной действительной температуры tд, определяется из i – t диаграммы; ηn – пирометрический коэффициент полезного действия процесса горения, учитывающий практическое значение тепловых потерь факелом при данных условиях сжигания топлива /15/.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.