Задача 1. В процессе изменения состояния 1 кг газа внутренняя энергия его увеличивается на Du. Показатель политропы n, начальная температура газа t1, конечное давление p2.
Определить для заданного газа, начальное давление p1 , начальный v1 и конечный v2объемы, совершаемую над газом работу l, изменение энтропии Ds и изменение энтальпии Dh. Представить процесс в р—v и Т—s диаграммах. Изобразить также (без расчета) изобарный, изохорный, изотермический и адиабатный процессы, проходящие через ту же начальную точку, и дать их сравнительный анализ.
Контрольный вопрос. Какова общая формулировка и математическое выражение первого закона термодинамики?
 Решение
РешениеПо уравнению изменения внутренней энергии определяем t2(T2)
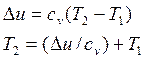
Теплоемкость cv принимаем постоянной и определяем по формуле ![]()
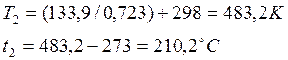
где mсv – удельная массовая (изохорная) теплоемкость воздуха при постоянном объеме mсv = 20,93 кДж/(кмоль К)
m – молекулярная масса воздуха m = 28,96 кг/кмоль
Из уравнения соотношений параметров политропы найдем давление р1:
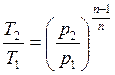
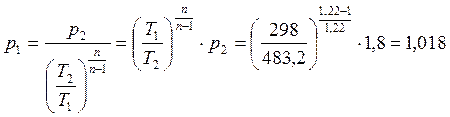
p1 = 1,018 МПа
Из уравнения состояния газа в первой точке находим v1и во второй точке находим v2:
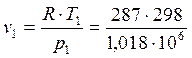 , v1 =0,084 м3/кг
, v1 =0,084 м3/кг
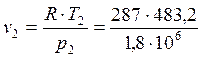 , v2 =0,0072 м3/кг
, v2 =0,0072 м3/кг
Работа совершаемая над газом определяется из выражения:
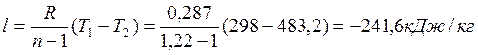
где R – газовая постоянная (для воздуха R=0,287кДж/(кгК)) [1]
т.к. работа совершается над газом , то работа l = - l241,6 кДж/кг
Изменение энтропии определяем по формуле:
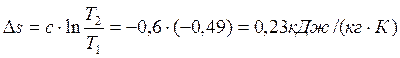
где c – теплоемкость политропного процесса определяем по формуле
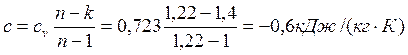
Изменение энтальпии Dh определяем по формуле
![]()
где ![]()
mср – удельная (изобарная) массовая теплоемкость воздуха при постоянном давлении mср = 29,31кДж/(кмоль К)
Контрольный вопрос. Какова общая формулировка и математическое выражение первого закона термодинамики?
Первый закон термодинамики
Тепловая энергия, подведенная к замкнутой термодинамической системе, расходуется на повышение ее внутренней энергии и работу, производимую системой против внешних сил.
Выражение первого закона термодинамики часто записывают в виде:
Q = DU – L
или
DU= Q – L
формулировка: изменение внутренней энергии рабочего тела в термодинамическом процессе равно разности между энергией между энергией, подведенной в форме теплоты и, и энергией, подведенной в форме работы.
Для 1 кг вещества
q = Du – l
В дифференциальной форме
dq = dDu – dl
т.к.
dl = pdv
то dq = dDu – pdv
Это первая форма записи математического выражения первого закона термодинамики.
Из уравнения соотношений
По уравнению изменения внутренней энергии определяем t2(T2):
![]()
![]()
![]()
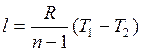
Задача 2. Определить параметры рабочего тела в характерных точках идеального цикла поршневого двигателя внутреннего сгорания с изохорно-изобарным подводом теплоты (смешанный цикл), если известны давление р1 и температура t1 рабочего тела в начале сжатия. Степень сжатия ε, степень повышения давления l, степень предварительного расширения r заданы.
Определить работу, получаемую от цикла, его термический КПД и изменение энтропии отдельных процессов цикла. За рабочее тело принять воздух, считая теплоемкость его в расчетном интервале температур постоянной.
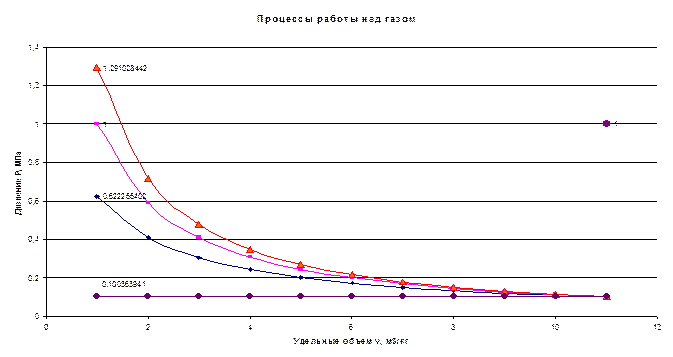
Построить на «миллиметровке» в масштабе этот цикл в координатах р—v и Т—s. Дать к полученным графикам соответствующие пояснения.
Контрольный вопрос. В чем смысл второго закона термодинамики?

Решение:
Использовав уравнения состояния и соотношения параметров можно рассчитать значение параметров рабочего тела в характерных точках теоретического цикла.
Точка 1.
По
уравнению состояния ![]()
определяем
начальный удельный объем 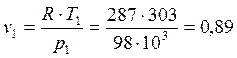
v1 =0,89 м3/кг
Точка 2.
Удельный объем в конце сжатия можно определить из параметра степень сжатия. Т.к. e =v1/v2 =16, то v2 = v1/ e =0,89/16=0,055
v2 =0,055 м3/кг
Идеальный цикл характеризуется процессом сжатия без потерь
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.