Химическая термодинамика
Тепловой эффект реакции ΔHr.
 Если
в ходе реакции теплота выделяется, т.е. энтальпия системы понижается ΔH<0, то реакция называется экзотермической. Энергетическая
диаграмма (энергетический профиль) экзотермической реакции имеет вид:
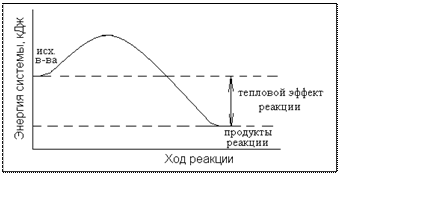
Если
в ходе реакции теплота выделяется, т.е. энтальпия системы понижается ΔH<0, то реакция называется экзотермической. Энергетическая
диаграмма (энергетический профиль) экзотермической реакции имеет вид:
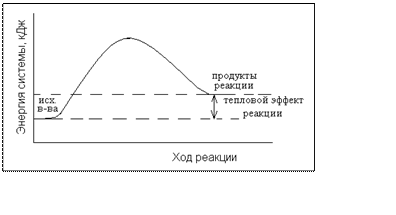
Если в ходе реакции теплота поглощается, т.е. энтальпия системы повышается ΔH>0, то реакция называется эндотермической. Энергетическая диаграмма эндотермической реакции имеет вид:
2 следствие из закона Гесса: ΔH0r = Σ ni ΔH0f прод - Σ ni ΔH0f исх ,
Для реакции: a A + b B = c C + d D,
ΔH0r = (c ΔH0f C + d ΔH0f D) – (a ΔH0f A + b ΔH0f B).
ΔS0r = Σ ni S0прод - Σ ni S0исх, [Дж/К]
Энергия Гиббса G: ΔG = ΔH – TΔS [кДж/моль]
Если ΔG0r < 0, то реакция протекает самопроизвольно в прямом направлении.
Если ΔG0r > 0, то прямая реакция невозможна, но может протекать обратный процесс.
Если ΔG0r=0, то система находится в состоянии химического равновесия.
ΔG0r = Σ ni ΔG0f (прод) – Σ ni ΔG0f(исх), [кДж]
ΔH
ΔG=0 => ΔH = TΔS => Т↔ = ——— -температура равновероятности
ΔS (температура начала реакции)
|
Знак |
Направление протекания реакции |
||
|
ΔН |
ΔS |
ΔG |
|
|
- ΔН<0 |
+ ΔS>0 |
- ΔG<0 |
Прямая реакция может идти самопроизвольно при любой температуре, но не может протекать обратный процесс |
|
+ ΔН>0 |
- ΔS<0 |
+ ΔG>0 |
Прямая реакция не может идти самопроизвольно при любой температуре, но может протекать обратный процесс |
|
- ΔН<0 |
- ΔS<0 |
± ΔG<0 при Т<Тр ΔG>0 при Т>Тр |
Самопроизвольно может идти прямая реакция при низких температурах и обратная при высоких температурах |
|
+ ΔН>0 |
+ ΔS>0 |
± ΔG<0 при Т>Тр ΔG>0 при Т<Тр |
Самопроизвольно может идти прямая реакция при высоких температурах и обратная при низких температурах |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.