В атмосфере большое число газов взаимодействуют одновременно. Поэтому для определения времени жизни какой-либо компоненты следует анализировать все возможные процессы ее образования и гибели. Например, для следующего набора:
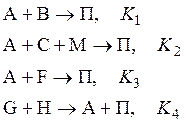
где П – продукты реакций, получаем:
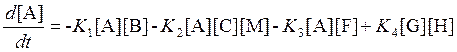 ,
,
откуда
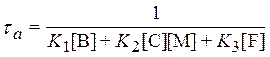 .
.
Как видите, для оценки времени жизни учитываются только
те процессы, которые приводят к разрушению молекулы А. Если это время малó
относительно процессов переноса, и концентрации В, С, F, G, Н не меняются
за это время, можно предположить существование фотохимического стационарного
состояния (равновесия). Это значит, что ![]() , следовательно
, следовательно
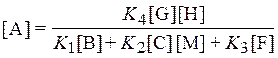 .
.
Столкновительная теория бимолекулярных реакций
Простые представления дают полезную схему
для понимания реакции двух тел. Очевидно,
что реакция А + В не может протекать со скоростью большей, чем скорость столкновения А и В. Представим,
что частицы являются твердыми сферами. Тогда константа скорости столкновений
между частицами ![]() см3/с, где Vr - относительная скорость
частиц, b - сечение столкновений: b =π(rA+ rB)2. Для типичных
молекул b - величина порядка 10-15 см2, а
относительная скорость частиц в условиях, близких к термодинамическому
равновесию,
см3/с, где Vr - относительная скорость
частиц, b - сечение столкновений: b =π(rA+ rB)2. Для типичных
молекул b - величина порядка 10-15 см2, а
относительная скорость частиц в условиях, близких к термодинамическому
равновесию,
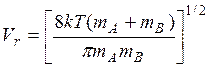 ,
,
где k - постоянная Больцмана, T - температура. Этот результат получен на основании распределения Максвелла для скоростей молекул газа, находящегося в термодинамическом равновесии. Для типичных масс mА, mB средняя относительная скорость Vr – величина порядка 4·104 см/с и КABимеет порядок величины 4∙10-11см3/с. Видно также, что Кав~ Т1/2.
На самом деле реальное взаимодействие между реагирующими газами гораздо сложнее, и не все константы скорости бинарных реакций равны 4·10-11см3/с. Точнее, для очень небольшого числа реакций получается такое значение константы. Причина - в ошибочности предположения, что частицы при столкновении ведут себя как твердые сферы.
В общем случае в ходе реакции частицы образуют промежуточные составляющие (их еще называют активированными комплексами). Грубо процесс представляется схемой, приведенной на рис.8.1
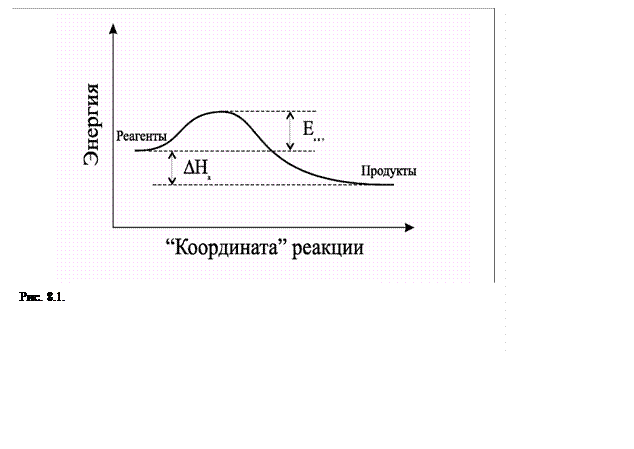 |
Доля сталкивающихся частиц с энергией Е
> Еакт определяется согласно больцмановскому распределению - ![]() . Далее, даже если энергия столкновения достаточна для
преодоления активационного барьера Еакт, реакция может не произойти из-за неудачной ориентации
сталкивающихся компонент. Поэтому следует ввести стерический фактор р,
показывающий, какая часть общего числа соударений
характеризуется «удобной» ориентацией. Тогда для Кавполучаем
известную формулу Аррениуса[5]:
. Далее, даже если энергия столкновения достаточна для
преодоления активационного барьера Еакт, реакция может не произойти из-за неудачной ориентации
сталкивающихся компонент. Поэтому следует ввести стерический фактор р,
показывающий, какая часть общего числа соударений
характеризуется «удобной» ориентацией. Тогда для Кавполучаем
известную формулу Аррениуса[5]:
![]() .
.
В детальном изложении теория соударений более сложна, но, в конце концов, она приводит к выражению, подобному приведенному выше.
Еще один источник возможных ошибок в модели твердых сфер заключается в природе взаимодействия сталкивающихся частиц. Например, в случае ионно-молекулярных реакций между реагентами действуют электрические силы притяжения, и такие реакции должны идти быстрее, чем следует из простой теории столкновения твердых сфер.
Мономолекулярные реакции
Особый случай мономолекулярных реакций следует рассмотреть отдельно. Каков механизм распада молекулы на составные части? Ведь данный тип реакции, на первый взгляд, нельзя понять на основе столкновительной теории бимолекулярных реакций.
В 1922 году Линдеманн (Frederick Alexander Lindemann, 1886-1957, – английский физик, советник по науке Уинстона Черчилля) выдвинул идею, впоследствии принятую учеными, что реакции, кажущиеся мономолекулярными, в действительности являются итогом трех процессов
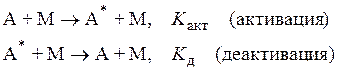
![]() .
.
Скорость разрушения А:
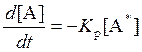 .
.
Равновесная концентрация компоненты А* определяется из уравнения
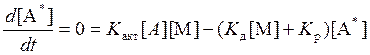 .
.
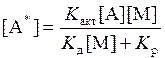 .
.
Подставим в предыдущее соотношение, считая, что концентрация [А*] действительно всегда равновесная. Тогда получим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.