Почти все компоненты атмосферы подвержены химическим и физическим превращениям, существенно влияющим на распределение этих компонент. Солнечная энергия может разрушать химические связи многих составляющих, образовывать активные фрагменты, способные взаимодействовать с другими компонентами атмосферы. Большинство этих фрагментов являются радикалами (частицами с одним или более неспаренными электронами). Большая часть существенных для атмосферы химических циклов включает реакции свободных радикалов.
Поглощение солнечной энергии атмосферными составляющими играет также важную роль в тепловом балансе, а следовательно[1], и в динамике атмосферы. Вот почему важно иметь представление об основных принципах фотохимии, кинетики и термодинамики.
Реакционная способность химических компонент атмосферы связана с их термодинамическими свойствами. В частности, чтобы оценить эффективность химического процесса, нужно знать энтальпию реакции.
Энтальпия образования химического соединения представляет собой энергию, необходимую чтобы создать (или разрушить) химические связи в соединении, начиная (или заканчивая) элементами в их наиболее стабильной форме. Например, такими как О2, N2, S и т.д. Таким элементам условно приписывается энтальпия образования, равная 0.
Замечание. Энтальпия H (или теплосодержание) не совпадает с внутренней энергией соединения. С внутренней энергией U энтальпия связана соотношением
H = U+ pV,
где p - давление, V - объем системы. Поэтому изменению DН энтальпии соответствует количество теплоты, которое сообщают системе (или отводят от нее) при постоянном давлении. Таким образом, значения DН характеризуют тепловые эффекты химических реакций и других процессов, протекающих при постоянном давлении.
Именно в таких условиях обычно и проводятся экспериментальные измерения тепловых эффектов различных процессов. Именно в таких условиях и протекает большинство химических реакций в атмосфере. Поэтому мы и оперируем понятием «энтальпия», а не «внутренняя энергия».
Пример. Образование двух атомов О в основном состоянии из О2. Энергия, необходимая для разрушения связи О=О при комнатной температуре, равна 120 ккал/моль. Поэтому энтальпия образования каждого атома О составляет ~60 ккал/моль.
Пример. Более общая реакция:
A + B → C + D.
Изменение энтальпии DН, связанное с этой реакцией, есть разность энтальпий образования продуктов реакции и энтальпий образования реагирующих компонент:
DНR = DН(C) + DН(D) - DН(A) - DН(B).
Если DНR<0, то в результате реакции избыток энергии реагирующих компонент превращается в тепло и реакция называется экзотермической. Если DНR > 0, для протекания реакции необходим источник энергии (тепла) и реакция называется эндотермической. Экзотермические реакции в атмосфере могут проходить спонтанно (самопроизвольно). Для эндотермических нужен источник дополнительной энергии, а его может и не быть.
Н и DН являются функциями температуры:
НT2 = НT1
+ 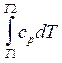 ,
,
где ср - теплоемкость при постоянном давлении. Приводимые в таблицах (см., например, [29]) значения DН для различных соединений обычно относятся к температуре 298.15 0K. Однако поправка, следующая из приведенной выше формулы, обычно мала в интервале атмосферных температур, и ею в первом приближении можно пренебречь.
Утверждение о том, что эндотермические реакции не могут идти без дополнительного источника энергии не совсем корректно. Для начала рассмотрим процесс, в котором не происходит изменения энтальпии. Например, смешивание инертных газов неона и гелия. Такой процесс самопроизвольно идет без изменения энтальпии, однако, обратный процесс разделения смеси на составляющие самопроизвольно не идет.
Это положение можно обобщить в следующей форме: система, для которой возможен переход из одного состояния в другое без изменения энергии, в результате оказывается в менее упорядоченном состоянии, которое, очевидно, более вероятно. Оказывается, что в ходе процесса смешения изменяется (растет) другая термодинамическая величина – энтропия.
В общем случае энтропия представляет собой меру беспорядка и случайности, характерных для рассматриваемого состояния. В частности, следует всегда ожидать увеличения энтропии в ходе реально возможного процесса (см. дополнительно разд. 13).
Большинство химических процессов сопровождается как изменением энтальпии, так и изменением энтропии. Эти два фактора независимы друг от друга. В физических системах одновременно действуют две конкурирующие тенденции: к минимуму энергии (энтальпии) и к максимуму энтропии. Обычно процесс идет в направлении, определяемом бóльшим изменением одной из величин. Это обстоятельство учитывается посредством оценки изменения свободной энергии Гиббса (включающей и энтальпию и энтропию):
DG = DН - TDS, (8.1)
где DS обозначает изменение энтропии. Тогда для рассмотренной выше реакции
DGR = DG(C) + DG(D) - DG(A) - DG(B).
Если DGR < 0, реакция может произойти спонтанно при рассматриваемых температурах. При этом реакция может быть как экзотермической, так и эндотермической. Для многих компонент атмосферы величины DG, DН, DS, сp измерены и затабулированы.
Пример. Предполагается, что реакция
NO3 + H2O → HNO3 + OH
может быть важным источником HNO3. Возможна ли она? Используя табличные данные, считаем
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.