если все вещества, участвующие в реакции, находятся в стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой ε0 данного элемента. Она, очевидно, равна:
ε0 = φ0к – φ0а
Из двух электродов гальванического элемента катодом будет тот, потенциал которого больше, анодом – электрод с меньшим потенциалом, т.е.:
φ0к > φ0а
При схематическом изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в растворе соли меди равен эдс цепи
Pt, H2|HCl||CuCl2|Cu|Pt
(две штриховые черты означают, что диффузионный потенциал на границе НС1 и СuС12 устранен).
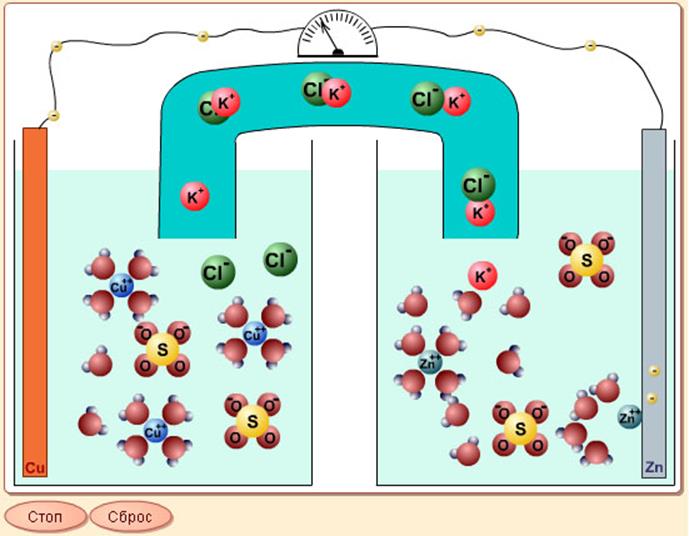
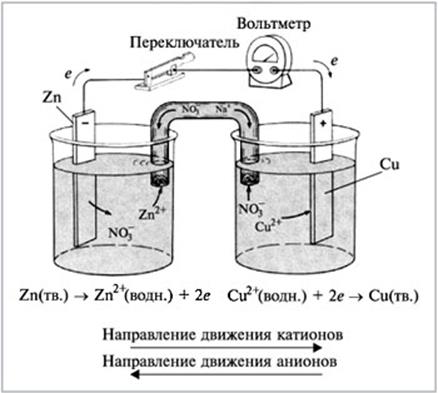
Рассмотрим медно-цинковый химический источник тока (ХИТ).
Схема медно-цинкового гальванического элемента:
(-) А [Zn/Zn(SO4)2||KCl|Cu/Cu(SO4)2] K (+).
Процесс на аноде (А): Zn0 – 2е = Zn2+ окисление
Процесс на катоде (К): Cu2+ + 2е = Cu0 восстановление
Солевой мостик с раствором KCl, соединяющий два сосуда, необходим для того, чтобы в область катода поступали катионы (K+,Zn2+), так как их недостаток возникает из-за восстановления катионов меди. В область анода поступают анионы (Cl-, SO42-), так как из-за образования новых катионов цинка возникает избыток положительного и недостаток отрицательного заряда. Происходит выравнивания количества положительно и отрицательно заряженных частиц.
Общее выражение окислительно-восстановительного процесса:
Zn0 + Cu2+= Zn2+ + Cu0
Для того, чтобы установить какой электрод будет катодом, а какой анодом, необходимо рассчитать значения электродных потенциалов по уравнению Нернста.
 анод(-)
анод(-)
Величина электродного потенциала полуреакции восстановления
вычисляется по уравнению Нернста: Е = Е0 + 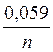 lg
lg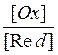 ;
;
Для медного электрода: Е = Е0 + 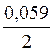 lg
lg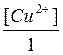 =
Е0 +
=
Е0 + 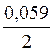 lg [Cu2+];
lg [Cu2+];
Для цинкового Е = Е0 + 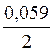 lg
lg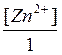 = Е0 +
= Е0 + 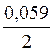 lg [Zn+2].
lg [Zn+2].
Если молярная концентрация катионов цинка и меди равна единице, потенциалы электродов будут равны стандартным: Е0Zn2+/Zn = -0,763B, E0Cu2+/Cu = 0,337B.
Так как потенциал медного электрода больше, он будет катодом, а цинковый электрод – анодом.
Стандартная э.д.с. (ε0) гальванического элемента связана со стандартной энергией Гиббса ΔrG0, протекающей в элементе реакции соотношением:
zFε0 = - ΔrG0, где z – число электронов, принимающих участие в реакции, F0 – постоянная Фарадея.
С другой стороны, ΔrG0 связана с константой равновесия К реакции уравнением:
ΔrG0 = -2,3RT∙lgK
Из двух последних уравнений следует:
zFε0 = 2,3RT∙lgK
Тогда константа равновесия будет равна:
K = 10zFε0/2,3RT = 10zFε0/0,059
Из уравнения zFε0 = - ΔrG0 можно сделать вывод о направлении протекания окислительно-восстановительной реакции. Так как реакция может самопроизвольно протекать в прямом направлении, если ΔrG0 <0, т.е. zFε0 >0, значит ε0 >0.
Так как: ε0 = φ0к – φ0а, то реакция будет протекать в направлении соответствующем неравенству: φ0к – φ0а >0 или φ0к > φ0а .
При ΔG°298 >> 0 и, следовательно, (φ°Ок - φ°Вс) « 0 реакции в прямом направлении протекать не будут, но термодинамически возможными становятся обратные реакции.
Реакция будет протекать в том направлении, в котором пара окисленная-восстановленная форма, имеющая большее значение стандартного потенциала, будет восстанавливаться.
Например, в каком направлении в стандартных условиях будет протекать реакция (Mn2+ - восстановитель, I2 - окислитель):
2 Mn2+ + 8 H2O + 5 I2 = 2 MnO4- + 16 H+ + 10 I-
В приведенном примере:
φ °Ок - φ °Вс = φ ° (MnO4- / Mn2+) - φ ° (I2/ I-) = + 0,535 - (+ 1,531) = - 0,996 В
в прямом направлении не протекает, но хорошо идет обратная реакция - восстановление перманганат-ионов с помощью иодид-ионов в кислой среде:
2 MnO4- + 16 H+ + 10 I- = 2 Mn2+ + 8 H2O + 5 I2
φ °Ок - φ °Вс = + 1,531 - (+ 0,535) = + 0,996 В
На практике считается, что если разность (φ°Ок - φ°Вс) >> + 0,4 В, то реакция окисления-восстановления протекает до конца (т.е. с высоким выходом, порядка 99,0 – 99,9%). Это означает, что реагенты проявляют сильные окислительные и восстановительные свойства соответственно. Часто для практически полного проведения реакции при большом положительном значении разности (φ°Ок - φ°Вс) достаточно взять сильный восстановитель или сильный окислитель. Если разность (φ°Ок - φ°Вс) лежит в пределах
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.