Методы защиты металлов от электрохимической коррозии
Для защиты металлов от электрохимической коррозии применяют следующие основные методы:
Этот метод защиты целесообразно применять при ограниченном объеме коррозионной среды. Защита при этом может быть достигнута:
А)Уменьшением содержания деполяризатора
Б) Введение замедлителей
Мы уже указывали, что Fe относится к группе металлов малостойких в кислых, недостаточно стойких в нейтральных и коррозионно – стойких в щелочных растворах.
Железо растворяется в HCl, причем с увеличением концентрации скорость растворения повышается. В H2SO4 максимальная скорость растворения Fe при 47-50%, затем резко уменьшается. Допускается перевозка 80-90% H2SO4 в железных цистернах. В стальных баллонах допускается перевозка HF концентрация не меньше 60%, при более низких концентрациях железа быстро разрушается.
В азотной кислоте железо пассивируется в интерконцентратор 50-94%. При малых концентрациях HNO3 быстро разрушается.
В органических кислотах коррозия железа намного меньше чем в минеральных (H2C2O4, HCOOH, CH3COOH). В щелочах железо устойчиво. Коррозия железа прекращается при pH>9,5. При концентрации > 30% NaOH защитные свойства немного уменьшаются, коррозия повышается. Железо сильно корродирует в расплавленных щелочах. Устойчиво в растворах аммиака.
На коррозионную стойкость нелигированных конструкционных сталей и чугунов влияет их неоднородность.
Основными структурными составляющими железоуглеродистых сталей являются:
А) Феррит (раствор «С» в α железе)
Б) аустенит (раствор «С» в γ железе)
Цементит Fe3C
В чугуне – несвязанный углерод (графит)
У всех этих составляющих различные величины электродных потенциалов.
Наиболее низкий электродный потенциал у феррита (-0,44 В) Наиболее высокий у графита (+0,37 В). Таким образом, разность потенциалов вследствие неоднородности структуры достигает 0,8 В. Поэтому коррозионные элементы в некоторых случаях могут работать весьма интенсивно, особенно в условиях протекания коррозионного процесса с водородной деполяризацией.
Неоднородность железоуглеродистых сталей по химическому составу оказывает влияние.
Так как в процессе растворения катодные составляющие выпадают, обнажая новые поверхности анодных составляющих.
А) Коррозионный процесс контролируется перенапряжением катодной реакции.
Катодные включения облегчают протекание процесса на катоде, снижая перенапряжение. Тем самым увеличивают скорость коррозии. Коррозия металлов в неокисленных кислотах, энергетическое перемешивание растворов). Корбит в сталях, графит в чугуне.
Катодные замедлители
Уменьшают скорость коррозии за счет снижения эффективности катодного процесса или сокращения площади катодов.
1. Поглотители кислорода (деаэраторы). Их действие основано на уменьшении содержания кислорода в растворе. То есть ослабление коррозии протекающей с кислородной деполяризацией.
Na2SO3→Na2SO4
NH2 - NH2 (гидразин) – 2H2O + N2
2. Повышающие перенапряжение катодного процесса. Восстанавливаются на катодных участках. AlCl3, Bi2(SO4)
(в кислых средах с водородной деполяризацией)
3. Экранирующие площадь катода
Cu(HCO3)2 + OH- = CuCO3↓ + HCO3- + H2O
ZnSO4 или ZnCL2 в щелочной среде из катода образуется Zn(OH)2↓
Катодные замедлители безопасны, так как при недостаточных концентрациях их в растворе они не вызывают усиления коррозии.
Органические замедлители
К органическим замедлителям коррозии относятся органические вещества, содержащие в молекулах полярные группы (амины и их соли), альдегиды и др., так каллоиды.
Механизм действия органических замедлителей коррозии в основном сводится к их аусорбции на катодных или анодных участках. Затрудняют соответственно катодный или анодный процесс коррозии.
Летучие замедлители
Летучие замедлители применяются для защиты от атмосферной коррозии. Эти вещества обладают достаточно высокой летучестью. Быстро заполняют атмосферу, адсорбируются на металлической поверхности, защищая ее от атмосферной коррозии.
Эти замедлители должны обладать способностью уменьшать гигроскопичность металлической поверхности.
Недостаток их в том, что после удаления их паров из атмосферы происходит прекращение защитного действия.
Морфолин, бензоит натрия (Na2(C6H5COO))
Эффективность действия ингибитора определяется защитным эффектом
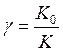 без ингибизации
без ингибизации
Легирование
На основании трех главных контролигирующих факторов коррозии – омического, катодного и анодного торможения процесса коррозии – намечается при возможных направления повышения коррозионной устойчивости сплава.
1. Создание сплавов, образующих более совершенный защитный слой продуктов коррозии на всей поверхности сплава.
2. Уменьшение катодной активности сплава.
3. Уменьшение анодной активности сплава.
Первое направление
Легирование
На основании 3х главных контролигирующих факторов коррозии – омического, катодного и анодного торможения процесса коррозии – намечается 3 возможных направления повышения коррозионной устойчивости сплава.
1. Создание сплавов, образующих более совершенный защитный слой продуктов коррозии на всей поверхности сплава;
2. Уменьшение катодной активности сплава;
3. Уменьшение анодной активности сплава.
Первое направление – создание пути легирования защитных свойств у продуктов коррозии.
Примером может служить: повышение коррозионной стойкости меди в атмосферных условиях при легировании алюминием.
Первое направление имеет сравнительно ограниченные возможности для повышения устойчивости металлов против электрохимической коррозии. Причина заключается в том, что образование продуктов коррозии, обладающих защитными свойствами происходит, как правило, не непосредственно на анодных поверхностях, а в растворе между анодными и катодными участками.
Второй путь – снижение катодной активности для гораздо больше число возможностей для повышения стойкости металлов. Есть 2 метода снижения катодной активности.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.