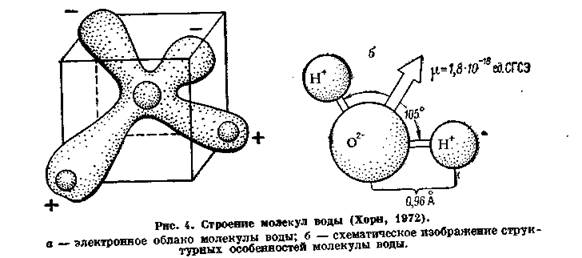
Представления о строении молекулы воды базируются в основном на исследовании ее газообразного состояния. Связь между атомами водорода и кислорода в молекуле ковалентная. Электронное облако молекулы имеет вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (рис. 4, а). Атом кислорода находится в центре, а два атома водорода — в противоположных углах одной из граней куба. Угол Н — О — Н составляет около 105°. Два из шести валентных электронов атома кислорода связаны с атомами водорода. Две неподеленные пары электронов образуют ветви, протягивающиеся к углам той грани куба, которая находится против грани, занятой атомами водорода. Эти ветви являются областями сосредоточения отрицательных зарядов. Они располагаются на расстоянии 0,9568 А от положительно заряженных атомов водорода. Молекула имеет, таким образом, полярное строение (диполь) со сравнительно большой величиной дипольного момента, достигающего (1,8- 10-18 ед. СГСЭ) (рис.4, б).
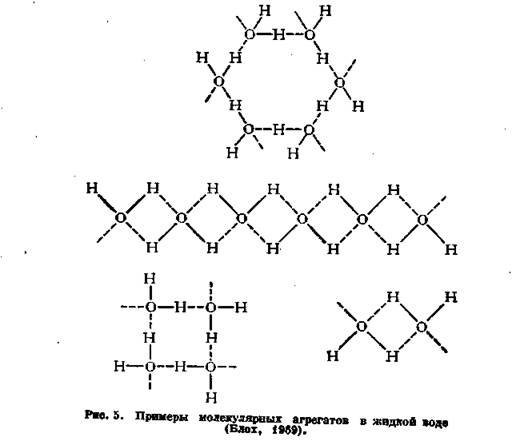
Каждая молекула воды способна образовать четыре водородные связи: за счет двух пар неподеленных электронов кислорода и двух положительно заряженных атомов водорода – и таким путем создавать агрегаты, построенные из молекул воды. Длина водородной связи равна 1,76 А.
Известные в настоящее время гипотезы о строении агрегатов молекул воды можно разделить на две группы. Одни исследователи считают, что у молекул воды реализуются все четыре водородные связи, вследствие чего структура воды имеет тетраэдрический характер; каждая ее молекула окружена по тетраэдру четырьмя другими молекулами. Другие* полагают, что реализуются только две связи, благодаря чему молекулы воды образуют линейные цепи, основу которых составляют так называемые водородные мостики (рис. 5).
* Опираясь на представления квантовой механики, М. Аджено полагает, что связь осуществляется с помощью водородных мостиков, которые образуют кольцевые структуры. Возможность их возникновения обеспечивается тем, что молекулы воды способны участвовать только в двух водородных связях: одной за счет водорода, другой за счет кислорода. Кольцевые образования могут создавать агрегаты различной конфигурации из двух, трех, четырех, пяти и шести молекул воды. В воде в один и тот же момент могут присутствовать все возможные типы агрегатов, а подвижное равновесие между ними зависит от термодинамического состояния системы.
Начало представлениям о тетраэдрическом характере структуры воды положили классические труды Дж. Бернала и Р. Фаулера. Эти ученые опирались на данные спектроскопии и рентгеноскопии и полагали, что воде присущи три типа расположения молекул (в зависимости от температуры):
вода I — типа льда-тридимита, образует тетраэдрически координированную решетку со структурой, похожей на искаженную структуру тридимита, существует при температуре ниже 4° С;
вода II — типа кварца, со структурой, напоминающей кварц, известна в интервале температур от 4 до 200° С;
вода III — плотно уложенная идеальная жидкость без заметных водородных связей, существует при температуре выше 200° С.
В настоящее время большинство исследователей опираются на теорию Дж. Бернала и Р. Фаулера. Основные положения, на которых базируются их разработки, сводятся к следующему:
1. Водяной пар не имеет структуры, он состоит преимущественно из мономерных молекул воды.
2. В твердом состоянии – в виде льда – вода в высокой степени упорядочена. Как следует из изучения структуры льда (методами рентгеноструктурного анализа и дифракции нейтронов), при атмосферном давлении кристаллы льда относятся к гексагональной системе (рис. 6). Атомы кислорода размещены в них так же, как и атомы кремния в структуре тридимита. Каждый атом кислорода связан с четырьмя другими, расположенными по тетраэдру на расстоянии 2,76 А от центрального атома кислорода. Таким образом, структура льда характеризуется координационным числом 4 (при максимально возможном числе 12) и является очень рыхлой, «ажурной». В ней много пустот, размеры которых даже несколько больше размеров самих молекул.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.