






Цель работы: знания зависимостей анодного выхода по току, линейной скорости анодного растворения и удельной энергоемкости электрохимического травления заготовки от плотности тока; умения экспериментально устанавливать эти зависимости и использовать их при решении конкретных задач.
Общие сведения
Электрохимическое травление поверхности заготовки, технологические особенности которого рассматриваются в данной работе, является одним из методов электрохимической обработки заготовок.
Электрохимическое травление может быть использовано для изготовления рельефных шкал, таблиц, фирменных знаков; для получения на металле сложных изображений со значительной глубиной рельефа вплоть до получения сквозных отверстий сложного профиля.
В основе электрохимического травления заготовки лежит анодное растворение металла в среде электролита при прохождении через электролит постоянного электрического тока, называемое электролизом. При этом методе обработки заготовка является анодом. Ниже представлена полная схема электролиза в технологической системе «электролит – электроды». Электролит здесь представлен водным раствором хлорида натрия NaCl, а анод–заготовка изготовлен из железа.
NaCl ↔ Na+ + Cl–
Катод: Na+ , Н2О Анод (Fe): Fe, Cl–, Н2О
2Н2О + 2e– = Н2 + 2(ОН)– Fe0 – 2e– = Fe2+ (выходит в раствор)
Na+ + (OH)– = NaOH Fe2+ + 2Cl– = FeCl2
2NaOH + FeCl2 = Fe(OH)2 + 2NaCl
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (выпадает в осадок).
Таким образом, на поверхности заготовки, обращенной к катоду, в результате окислительной реакции происходит растворение металла. Для защиты тех частей заготовки, которые не должны подвергаться формоизменению, используются изолирующие покрытия (маски), наносимые на поверхности фотохимическим или другими способами.
Интенсивность анодного растворения описывается первым законом Фарадея
m
= kэхIt![]() , (1.44)
, (1.44)
где m – масса металла, растворенного на аноде, кг; kэх – электрохимический эквивалент материала анода, кг/Кл; I – сила тока, А; t – время протекания процесса, мин.
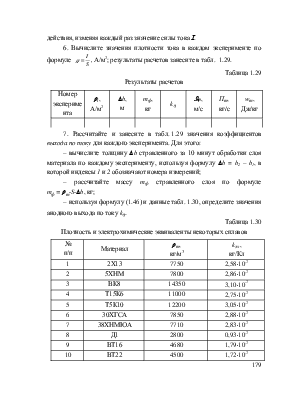
На практике масса растворенного на аноде вещества mф оказывается меньше массы, рассчитанной по закону Фарадея. Эту особенность процесса учитывают введением в формулу (1.44) коэффициента kh, называемого коэффициентом выхода по току. Фактическую массу металла, растворенного на аноде, рассчитывают по формуле
mф = khkэхI·t . (1.45)
Ввиду большого числа факторов, влияющих на коэффициент kh, найти его значение теоретическим путем не удается. Поэтому на практике выход по току определяют экспериментально через отношение
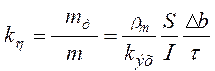 , (1.46)
, (1.46)
где rm — плотность материала анода, кг/м3; S — площадь анода, подлежащая травлению, м2; Db — толщина слоя, растворенного на аноде, м.
Линейная скорость растворения Jр, м/мин, может быть определена следующим образом:
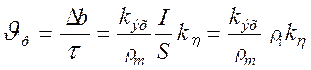 , (1.47)
, (1.47)
где ri — плотность тока, А/м2.
Расчеты по формуле (1.47) затруднены в связи с тем, что с увеличением плотности тока падает значение выхода по току. Это вызвано пассивацией анода, т. е. покрытием его нерастворимой оксидной пленкой. Явление пассивации анодной поверхности приводит также к значительному увеличению удельной энергоемкости процесса, значение которой wm, Дж/кг рассчитывают по формуле:
wm = I×U×t/mф , (1.48)
где U — напряжение на электродах, В.
Из формулы (1.48) следует, что удельная энергоемкость wm процесса электрохимического травления с возрастанием силы тока I увеличивается. Росту wm способствует еще и то, что одновременно падает выход по току.
Лабораторная установка ЭХТ–97
Лабораторная установка ЭХТ–97 (рис. 1.56) работает от источника тока 1. Источник снабжен встроенными вольтметром 2 и амперметром 3, которые позволяют контролировать ступенчато изменяемые при переключении тумблеров 12 значения силы тока и напряжения на электродах. Ток от источника по гибким шинам подается на электроды 6 и 7, выполненные в виде пластин. Пластина 6, являющаяся катодом, закреплена при помощи кронштейна 5 на стенке емкости 4, выполненной из химически стойкого материала. Емкость заполнена 15 % водным раствором хлорида натрия.
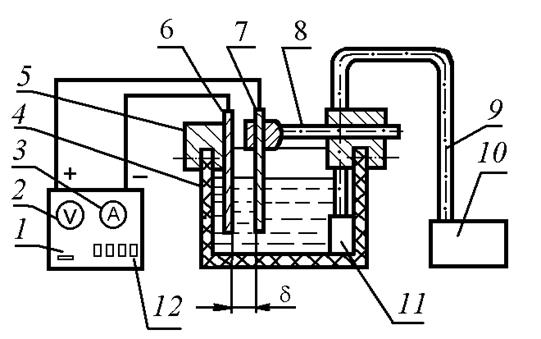
Рис. 1.56. Схема установки ЭХТ–97
Вторая пластина 7, представляющая анод, закреплена на противоположной стенке емкости 4 при помощи подвижного кронштейна 8, который дает возможность изменять межэлектродный зазор d. Для эффективного удаления продуктов анодного растворения из межэлектродного промежутка электролит перемешивают потоком воздуха, подаваемого в емкость 4 по гибкому трубопроводу 9 от компрессора 10. Для предотвращения образования больших воздушных пузырей и выплескивания электролита из емкости конец трубопровода 9 снабжен рассеивателем 11.
Работа включает изучение технологических характеристик и основных закономерностей электрохимического травления заготовок, проведение эксперимента по определению зависимости параметров электрохимического травления от плотности тока, выполнение индивидуального задания и подготовку отчета.
Последовательность выполнения работы
1. Ознакомьтесь с устройством и принципом работы лабораторной установки ЭХТ–97.
2. Совместно с преподавателем разберите представленные в начале работы формулы химических реакций, протекающих в технологической системе при электрохимическом травлении.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.