на некогерентных центрах адсорбции
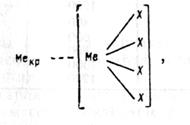 |
где Мекр — атом кристаллической решетки; Ме — атом металла в исходном соединении типа SiС14; X — атом галогена в этом соединении или кислорода в соединении типа SiO2.
Чем сильнее связь Мекр—Ме по сравнению со связью Ме—X, тем более вероятен разрыв последней, в результате чего атомы X десорбируются с грани кристалла, а атом Ме остается на ней, достраивая решетку подложки (рис. 1.2,6). И наоборот, при более сильной связи Ме—X вероятнее становится разрыв связи Меко—Ме, что может привести к образованию других соединений (например, SiO2 при окислении кремния) или травлению подложки с переводом атомов Мекр в газовую или жидкую фазу.
Оценить термодинамическую возможность и преимущество той или иной химической реакции в заданном температурном интервале позволяют расчеты изобарно-изотермического потенциала DG (свободной энергии Гиббса) и константы равновесия Kр процесса, значения которых определяют направление самопроизвольного протекания реакции и помогают выбрать термодинамически наиболее выгодные системы.
Изменения термодинамических функций в химическом процессе связаны между собой и с константой равновесия KР известными соотношениями:
(1.4)
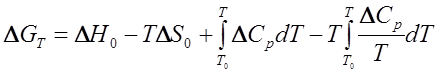 |
(1.5)
Таблица 1.1. Расчетные значения DGи lnКрреакций, применяемых для эпитаксии кремния
|
Уравнение реакции |
г. к |
DGT кДж/моль |
Ш/ср |
|
51Р4+2Н2=51+4НР |
600 |
429,5 |
—85,9 |
|
1000 |
363,7 |
—43,7 |
|
|
1200 |
331,8 |
—33,2 |
|
|
51С14+2Н2=51+4НС1 |
600 |
173,5 |
—34,7 |
|
1000 |
101,8 |
—12,2 |
|
|
1200 |
66,6 |
—6,7 |
|
|
1400 |
32,3 |
—2,8 |
|
|
51НС13 + Н2=5И-ЗНС1 |
600 |
141,2 |
—28,3 |
|
800 |
92,2 |
— 13,8 |
|
|
1000 |
33,5 |
—4,0 |
|
|
1200 |
—30,8 |
3,0 |
|
|
51Н4=51+2Н2 |
400 |
—64,9 |
19,5 |
|
600 |
—83,4 |
16,7 |
|
|
800 |
— 102,6 |
15,4 |
|
|
1000 |
— 122,3 |
14,7 |
|
|
1200 |
— 142,0 |
14,2 |
где DGT— свободная энергия реакции при температуре процесса Т; DH0, DS0 — энтальпия и энтропия реакции при стандартных условиях (T0 = 298,15 К; p0= 1,01-105 Па); DCР — изменение теплоемкости участников реакции.
Значения DGT и lnKp реакций, используемых для эпитаксиального осаждения пленок кремния, приведены в табл. 1.1.
При постоянных температуре и давлении термодинамически вероятнее та реакция, которая сопровождается более значительным уменьшением свободной энергии DGT. Предельное время протекания реакции определяется моментом наступления равновесия, т. е. условием DGT=0. Согласно (1.4) самопроизвольному течению реакции способствуют большие отрицательные значения DHT (выделение большого количества энергии в ходе процесса) и высокие положительные значения DST (возрастание энтропии).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.