Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 6р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
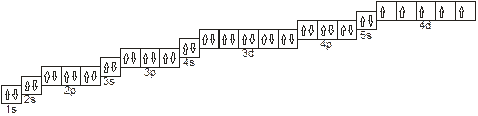
Решение: Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами Символов nlx, где n — главное квантовое число, 1 — орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение — s, p, d, f), х — число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией — меньшая сумма п + 1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1) →4f→5d→6p→7s→(6d1-2) →5f→6d→7p
Отсюда видим что 5s заполняется раньше чем 4d и что 6s заполняется раньше чем 6p. Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице д.И. Менделеева, то для элемента с порядковым номером 43 т.е. Тс (технеций) электронная формула примет вид:
(43 Тс) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 или (43 Тс) [Br] 5s2 4d5
Задание № 3(47)
Какой из элементов четвертого периода — ванадий или мышьяк — обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с Водородом? Ответ мотивируйте, исходя из строения атомов – данных элементов.
Решение: Кристаллические решетки, в узлах которых находятся положи тельные ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называются металлическими. Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующих Кристаллическую решетку, называется металлической.
Свойства химических элементов зависят от электронной конфигурации их атомов.
Рассмотрим, свойства элемента, имеющего в периодической системе порядковый номер 23(V(ванадий)). Принимая во внимание принцип наименьшего запаса энергии я принцип Паули, для этого элемента можно написать такую электронную формулу: 1s2 2s2 2p6 3s2 3p6 3d3 4s2 . Из этой электронной формулы следует, что элемент находятся в четвертом периоде (n = 4), в пятой группе (атом имеет пять валентных электронов: 3d3 4s2 в побочной подгруппе (валентные электроны находятся на d-орбитали предпоследнего слоя и s -орбитали внешнего слоя). Элемент является металлом, так как в наружном электронном слое его атома имеется два электрона. Принимать дополнительные электроны элементу энергетически невыгодно. Элемент должен образовывать несколько оксидов, из которых низший оксид ЭО должен проявлять основные свойства, а высший Э2О5, — кислотные. Элементу принимать дополнительные электроны энергетически невыгодно, а значит, не образует газообразных соединений с водородом.
Электронная формула атома элемента с порядковым номером 33(As(мышьяк)) имеет вид: ) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 Элемент находится в четвертом периоде (n = 4. в пятой группе (атом имеет пять валентных электронов — 4s2 4p3), в главной подгруппе (валентные электроны расположены в наружном электронном слое). Высшая степень окисления равна 5, значит, элемент является неметаллом, так как легко может присоединять три электрона до устойчивой конфигурации инертного газа. С водородом элемент образует газообразное соединение H3Э.
Поэтому элемент четвертого периода — ванадий обладает более
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.