оксидов, из которых низший оксид ЭО должен проявлять основные свойства, а высший Э2О5, — кислотные. Элементу принимать дополнительные электроны энергетически невыгодно, а значит, не образует газообразных соединений с водородом.
Электронная формула атома элемента с порядковым номером 33(As(мышьяк)) имеет вид: ) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 Элемент находится в четвертом периоде (n = 4. в пятой группе (атом имеет пять валентных электронов — 4s2 4p3), в главной подгруппе (валентные электроны расположены в наружном электронном слое). Высшая степень окисления равна 5, значит, элемент является неметаллом, так как легко может присоединять три электрона до устойчивой конфигурации инертного газа. С водородом элемент образует газообразное соединение H3Э.
Поэтому элемент четвертого периода — ванадий обладает более выраженными металлическими свойствами чем мышьяк и мышьяк с водородом образует газообразное соединение H3Э.
Задание № 5
Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
|
Элемент |
Степени окисления |
Химические соединения |
||
|
Низшая. |
Высшая. |
Низшая. |
Высшая. |
|
|
С |
- 4 |
+ 4 |
Al4C3 – Метанид алюминия |
СО2 – Углекислый газ СаСО3 – Карбонат кальция |
|
P |
- 3 |
+ 5 |
Na3P – Фосфид натрия |
Н3РО4 – Ортофосфорная кислота |
|
S |
- 2 |
+ 6 |
Al2S3 – Сульфид алюминия |
Н2SO4 – Серная кислота |
|
J |
- 1 |
+ 7 |
KJ – Йодит калия |
NaJO4 – Периодат натрия |
Задание № 6
Распределите электроны атомов серы по квантовым ячейкам. Сколько неспаренных электронов имеют өө атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
Решение: Распределение электронов внешнего энергетического уровня серы (16 S) 1s2 2s2 2p6 3s2 3p4 (учитывая правило Хунда, 3s2 3px 3py 3pz) по квантовым ячейкам имеет вид:
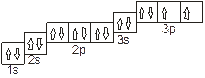
Атомы серы имеют свободные ‚d-орбитали, поэтому возможен переход одного 3s-электрона и одного 3p- электрона в 3d-состояние:
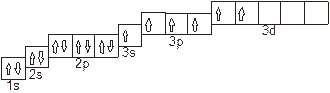
Отсюда валентность (спинвалентность) серы в нормальном состоянии равна трём, а в возбуждённом – шести.
Задание № 7
Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
Энергетическая схема образования молекулярных орбиталей и их заселённость в молекуле азота:
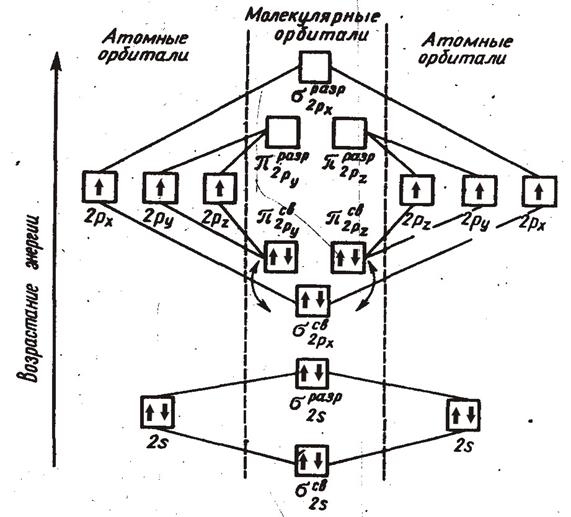
Образование химической связи в молекуле азота (N2):
N [1s22s22p3] + N [1s22s22p3] → N2 [KK(σ2S)2 * (σ2S)2 * (σ2P)2 * (π2P)4 ]
Коэффициент КК обозначают заполненные орбитали, а именно (σ2S)2 (σ2S)2;
(π2P)4
– занятые πY.2P и πZ.2P – орбитали. В молекуле азота шесть связывающих
электронов расположены на трёх молекулярных орбиталях, что можно рассматривать
как тройную связь, образованную одной σ и двумя π
– связями взаимно перпендикулярными обусловленными молекулярными π42P и π22P – орбиталями.
Порядок связи = ![]() .
.
Задание № 8
Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
|
![]()
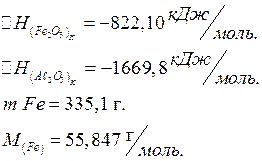
![]()
Ответ: Q = 2543,1кДж.
Задание № 9
При какой температуре наступит равновесие системы
![]()
Хлор в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К.
Решение: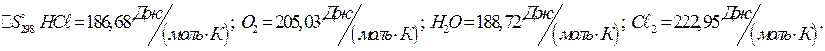
![]()
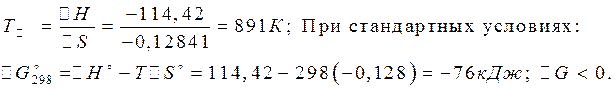
Т. е.при 298 К – Т
преобладает прямая реакция О2 сильнее Cl2 ; Т = 1000 К ![]() ,
т. е. преобладает обратная реакция в этих условиях Cl2
сильнее О2.
,
т. е. преобладает обратная реакция в этих условиях Cl2
сильнее О2.
Задание № 10
Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были: [N2] =0,049 моль/л; [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO] = 0,005 моль/л. Ответ: [N2] =0,0465 моль/л;
[О2] = 0,0075 моль/л.
|
Исх. Конц.
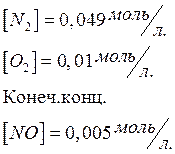
![]()
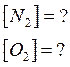
Ответ: [N2]
= 0,0465 моль/л; [О2] = 0,0075 моль/л.
Задание № 11
Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора НNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4л этого раствора? Ответ:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.