Как и для атома водорода энергия каждого электрона зависит в основном от значения главного квантового числа п. При этом электроны с меньшими значениями п имеют меньшую в алгебраическом смысле и большую по абсолютной величине энергию:
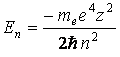 , (1.1)
, (1.1)
где п =1; 2; 3; ….
Орбитальное квантовое число характеризует орбитальный момент импульса:
![]() , (1.2)
, (1.2)
где ![]() = 0; 1; 2; …п
–1. Всего
= 0; 1; 2; …п
–1. Всего ![]() принимает п значений.
принимает п значений.
Магнитное квантовое число определяет проекцию момента импульса на выделенное направление в пространстве (направление поля Н):
![]() , (1.3)
, (1.3)
где ![]() = 0; ±1; ±2;
… ±
= 0; ±1; ±2;
… ±![]() ;
; ![]() принимает (2
принимает (2![]() +
1) значения.
+
1) значения.
Спиновое квантовое число ![]() описывает
проекцию спина электрона на выделенное направление в пространстве:
описывает
проекцию спина электрона на выделенное направление в пространстве:
![]() , (1.4)
, (1.4)
где ![]() .
.
Величина спина у электрона принимает одно
значение и определяется квантовым числом ![]() :
:
![]() . (1.5)
. (1.5)
Поскольку электрон обладает электрическим
зарядом, его можно уподобить электрическому току, который можно
охарактеризовать орбитальным магнитным моментом ![]() и
спиновым магнитным моментом
и
спиновым магнитным моментом ![]() . Магнитные
моменты направлены в сторону, противоположную соответствующим механическим
моментам, и могут принимать лишь определенные значения.
. Магнитные
моменты направлены в сторону, противоположную соответствующим механическим
моментам, и могут принимать лишь определенные значения.
Орбитальный магнитный момент ![]() квантуется по закону:
квантуется по закону:
![]() , (1.6)
, (1.6)
где 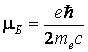 – магнетон Бора.
– магнетон Бора.
Проекция орбитального магнитного момента на направление поля равна:
![]() . (1.7)
. (1.7)
Спиновый магнитный момент квантуется по закону:
![]() . (1.8)
. (1.8)
Проекция спинового магнитного момента на направление поля принимает два значения:
![]() . (1.9)
. (1.9)
С орбитальным магнитным моментом ![]() связано некоторое магнитное поле.
Проекция спинового магнитного момента
связано некоторое магнитное поле.
Проекция спинового магнитного момента ![]() на
направление этого поля может принимать два значения
на
направление этого поля может принимать два значения ![]() .
Энергия этих двух состояний, равная
.
Энергия этих двух состояний, равная ![]() , различна. В
результате все уровни с
, различна. В
результате все уровни с ![]() ¹ 0 оказываются дублетными (двойными).
Энергия спин – орбитального взаимодействия зависит от квантовых чисел
¹ 0 оказываются дублетными (двойными).
Энергия спин – орбитального взаимодействия зависит от квантовых чисел ![]() и
и ![]() .
Наличие этого взаимодействия приводит к дополнительному «тонкому» расщеплению
электронных уровней с одинаковыми п и
.
Наличие этого взаимодействия приводит к дополнительному «тонкому» расщеплению
электронных уровней с одинаковыми п и ![]() ,
но с разной ориентацией спинового момента по отношению к орбитальному моменту.
,
но с разной ориентацией спинового момента по отношению к орбитальному моменту.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.