28.03.2002
Адсорбция ионов и образование двойного электрического слоя
(коллоквиум №2)
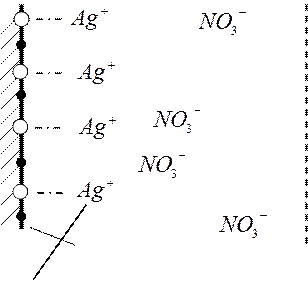 |
AgI
![]() - Ag+ Раствор
- Ag+ Раствор
![]()
![]() - I -
- I -
поверхность кристалла малорастворимого соединения, погружённого в воду
т.о. мы можем сказать, что кристалл достраивается за счёт ионов из раствора (происходит образование не очень прочной химической связи), этот ряд упорядоченных адсорбированных ионов (в данном случае, ионов Ag+) имеет название адсорбционного слоя.
На поверхности твёрдого вещества из раствора адсорбируются ионы, но только те, которые образуют малорастворимое соединение с поверхностью твёрдого тела. Т.е. идёт процесс избирательной адсорбции. Ионы NO3- не адсорбируются, потому что вещество AgNO3 хорошо растворимо. Это явление также называют специфической адсорбцией.
В результате избирательной адсорбции поверхность заряжается и к ней начинают притягиваться ионы с противоположным по знаку зарядом (NO3-). В результате этого образуется двойной электрический слой – т.е. система пространственно разделённых зарядов на границе раздела фаз.
Адсорбированные заряды (Ag+, это те, которые были адсорбированы выборочно) лежат упорядоченно строго в одной плоскости, из-за чего они образуют заряженную поверхность, которая имеет конкретные характеристики:
заряд единицы поверхности (плотность заряда поверхности)
потенциал единицы поверхности
Заряд поверхности компенсируется слоем противоионов. Этот слой имеет определённую толщину, он не является плоским, а распределяется в объёме, но его заряд равен заряду поверхности.
Ионы, заряжающие поверхность называются потенциал определяющими;
Ионы объёмного слоя, которые нейтрализуют создаваемый заряд, называются
противоионами.
Пример выполнения правила избыточной адсорбции Фаянса
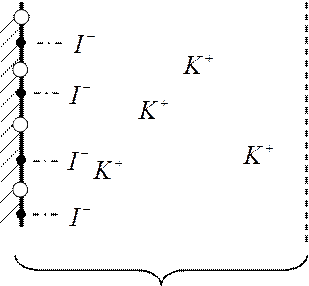 |
AgI
раствор KI
ДИС (двойной ионный слой)
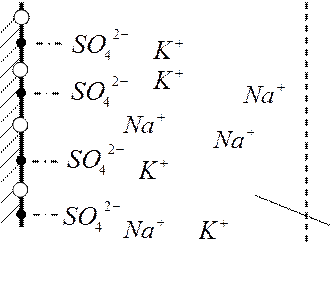 |
BaSO4
раствор Na2SO4
в KCl
количество
NaSO4 – потенциалопределяющий электролит
KCl – индифферентный электролит
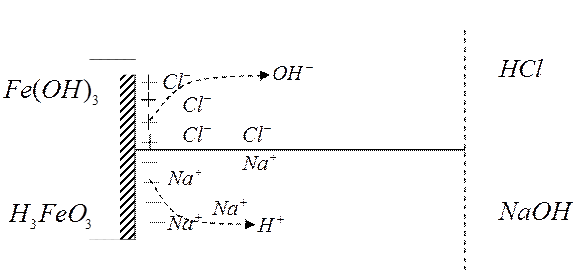 Образование двойного ионного слоя из-за
поверхностной диссоциации (особенно это характерно для оксидов и гидроксидов) –
поверхностное растворение
Образование двойного ионного слоя из-за
поверхностной диссоциации (особенно это характерно для оксидов и гидроксидов) –
поверхностное растворение
Величина и знак
заряда поверхности
определяются
исключительно pH
раствора
Ионообменная адсорбция
Ионы внешней части двойного слоя легко замещаются другими ионами при добавлении иного электролита.
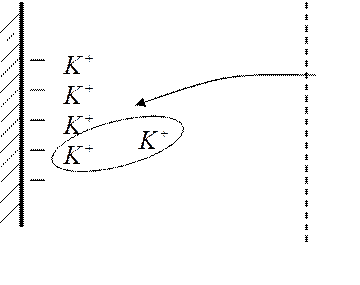 |
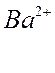
 BaCl2 – только
BaCl2 – только
индеферентный электролит
Барий будет притягиваться
к поверхности сильнее, т.к. его
заряд больше. Этот процесс за-
мещения ионов получил назва-
ние ионного обмена или ион-
нообменной адсорбции.
Это адсорбция, заключающаяся в том, что из раствора поглощаются одни ионы, а выделяются другие того же знака и в эквивалентном количестве.
По способности к ионообменной адсорбции ионы располагают в ряд:
![]()
![]()
![]()
![]() Li+ Na+
K+ Rb+
Cs+
Li+ Na+
K+ Rb+
Cs+
Наименьший атомный радиус имеет атом лития, наибольший – цезия. Каждый из атомов этого ряда имеет одинаковый заряд +1, но т.к. атом лития очень мал, напряжённость создаваемого его зарядом поля будет больше, чем у остальных. За счёт этого он сможет создать наибольшую гидратную оболочку. Т.к. минимальный размер с учётом гидратной оболочки будет у цезия, то он сможет подойти на самое близкое расстояние к поверхности и ему будет легче, чем остальным заместить атомы.
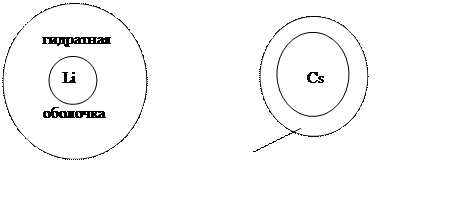 |
гидратная обо-
лочка
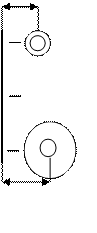 |
Как видно из рисунка, цезий, несмотря на
свой большой размер из-за маленькой гидрат-
ной оболочки подойдёт ближе к заряженной по-
врехности и будет лучше с ней взаимодейство-
вать, а значит он будет лучше вытеснять
другие ионы
Теория Двойного Электрического Слоя
Строение ДЭС
Важнейшим элементом строения ДЭС, является строение его внешней части, т.к. она как бы размыта (размазана) и, следовательно, подвержена изменениям. А его внутренняя область остаётся практически постоянной при изменении внешних условий.
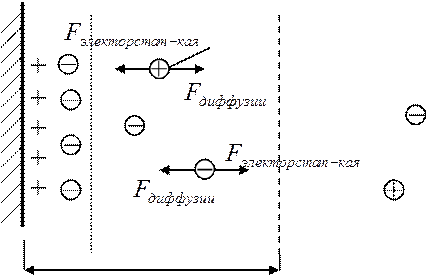 |
ко-ион (ион, имеющий тот же заряд, что и внутренняя часть слоя ДЭС)
Внешняя часть ДЭС
ДЭС Остальная часть
раствора
(суммарный заряд ДЭС равен нулю, т.е., число «плюсов» равно числу «минусов»
ДЭС формируется под действием электростатического взаимодействия ионов с заряженной поверхностью и силой диффузии (которая стремиться выровнять концентрацию различных ионов во всём объёме раствора.
Закон разбавления Больцмана – концентрация положительных (отрицательных) ионов равна:
- концентрация ионов в растворе с нулевым зарядом.
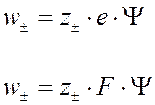
потенциальная энергия иона (сила его электростатического
взаимодействия
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.